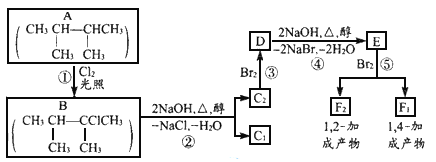
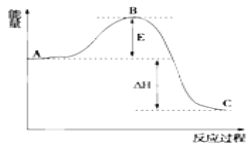
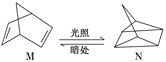
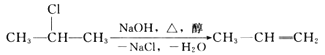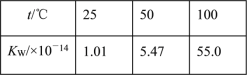题目内容
【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
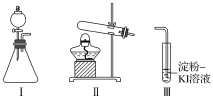
供选试剂:30%H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下
操作 | 现象 | |
甲 | 向I的锥形瓶中加入___,向I的____中加入30%H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/LH2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是____。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___。为进一步探究该条件对反应速率的影响,可采取的实验措施是___。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列_____(填字母)溶液,证明了白雾中含有H2O2。
A.酸性KMnO4 B.FeC12 C.Na2S D.品红
【答案】MnO2固体 分液漏斗 O2+4I-+4H+=2I2+2H2O 酸性环境 使用不同浓度的稀硫酸作对比实验 AD
【解析】
(1)根据装置甲的特点,用过氧化氢与二氧化锰反应制取氧气;
(2)根据丙的实验现象,在酸性条件下氧气与碘离子反应生成碘单质和水;
(3)对比乙、丙实验可知,不同之处为是否加入硫酸;为探究酸的浓度对反应速率的影响,使用不同浓度的稀硫酸做对比实验;
(4)白雾中含有H2O2、O2,均具有氧化性,据此判断。
(1)根据装置甲的特点,用过氧化氢与二氧化锰反应制取氧气,则在锥形瓶中加入二氧化锰固体,在分液漏斗中加入30%H2O2溶液;
(2)根据丙的实验现象,在酸性条件下氧气与碘离子反应生成碘单质和水,反应的离子方程式为O2+4I-+4H+=2I2+2H2O;
(3)对比乙、丙实验可知,不同之处为是否加入硫酸,则反应适宜条件为酸性;为探究酸的浓度对反应速率的影响,使用不同浓度的稀硫酸做对比实验;
(4)白雾中含有H2O2、O2,均具有氧化性。
A.白雾遇到酸性KMnO4只与H2O2反应,现象为高锰酸钾溶液褪色,可验证含有H2O2,A正确;
B.白雾与FeC12 混合时,氧气也能使亚铁离子生成铁离子,不能验证是否含有H2O2,B错误;
C.白雾与Na2S混合时,氧气也能使硫离子生成单质硫,不能验证是否含有H2O2,C错误;
D.白雾与品红混合时,只有过氧化氢使品红溶液褪色,可验证存在H2O2,D正确;
答案为AD。

【题目】下列根据实验操作和实验现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将FeCl2样品溶于盐酸后,滴加KSCN溶液 | 溶液变成红色 | 原FeCl2样品已变质 |
B | 将Na2SO3样品溶于水,滴加入稀盐酸酸化的Ba(NO3)2溶液 | 产生白色沉淀 | 原Na2SO3样品已变质 |
C | 向淀粉KI溶液中滴入3滴稀硫酸,再加入10%的H2O2溶液 | 滴入稀硫酸未见溶液变蓝;加入H2O2溶液后,溶液立即变蓝 | 酸性条件下,H2O2氧化性强于I2 |
D | 向5mL0.5mol/LNaHCO3溶液中滴入2mL1mol/LBaCl2溶液 | 产生白色沉淀,且有无色气体生成 | 反应的化学方程式为2NaHCO3+BaCl2=BaCO3↓+ 2NaCl+CO2↑+H2O |
A. AB. BC. CD. D