题目内容
Ⅰ. 在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:
Cr2O72-+H2O 2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液后,溶液呈 色,因为 。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4后,则溶液呈 色,因为 。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡向 方向移动,溶液颜色将 。(填“变深”、“变浅”或“不变”)
Ⅱ.实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
1.配制100mL 0.10mol/L NaOH标准溶液。
2.取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。
3.重复上述滴定操作2~3次,记录数据如下。
(1)滴定达到终点的现象是 ,此时锥形瓶内溶液的pH范围为 。
(2)根据上述数据,可计算出该盐酸的浓度约为 。
(3)排去碱式滴定管中气泡的方法应采用下图 的操作,然后挤压玻璃球使尖嘴部分充满碱液。



甲 乙 丙
(4)在上述实验中,下列操作(其它操作正确)会造成测定结果偏高的有 (多选扣分)。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中
E.配制NaOH标准溶液时,定容时仰视容量瓶的刻度线
F.碱式滴定管尖嘴部分有气泡,滴定后消失
Cr2O72-+H2O
 2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。(1)向上述溶液中加入NaOH溶液后,溶液呈 色,因为 。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4后,则溶液呈 色,因为 。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡向 方向移动,溶液颜色将 。(填“变深”、“变浅”或“不变”)
Ⅱ.实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
1.配制100mL 0.10mol/L NaOH标准溶液。
2.取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。
3.重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.58 | 20.00 |
| 3 | 0.10 | 22.60 | 20.00 |
(1)滴定达到终点的现象是 ,此时锥形瓶内溶液的pH范围为 。
(2)根据上述数据,可计算出该盐酸的浓度约为 。
(3)排去碱式滴定管中气泡的方法应采用下图 的操作,然后挤压玻璃球使尖嘴部分充满碱液。



甲 乙 丙
(4)在上述实验中,下列操作(其它操作正确)会造成测定结果偏高的有 (多选扣分)。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中
E.配制NaOH标准溶液时,定容时仰视容量瓶的刻度线
F.碱式滴定管尖嘴部分有气泡,滴定后消失
Ⅰ.每空1分(1)黄;中和H+,使c(H+)减小,平衡向正反应方向移动
(2)橙红色;增加生成物c(H+),平衡向逆反应方向移动 (3)正反应(右) 变浅
Ⅱ.(1)①最后一滴氢氧化钠溶液加入,溶液由无色恰好变浅红色,且半分钟内不褪色 ②8.2~10 (2)0.1130mol/L(不写单位扣1分) (3)丙 (4)EF(2分)
(2)橙红色;增加生成物c(H+),平衡向逆反应方向移动 (3)正反应(右) 变浅
Ⅱ.(1)①最后一滴氢氧化钠溶液加入,溶液由无色恰好变浅红色,且半分钟内不褪色 ②8.2~10 (2)0.1130mol/L(不写单位扣1分) (3)丙 (4)EF(2分)
试题分析:Ⅰ.(1)向上述溶液中加入NaOH溶液后,溶液中OH-浓度增大,中和氢离子,降低氢离子的浓度。则根据Cr2O72-+H2O
 2CrO42-+2H+可知,平衡向正反应方向移动,所以溶液呈黄色。
2CrO42-+2H+可知,平衡向正反应方向移动,所以溶液呈黄色。(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4后,增加生成物c(H+),平衡向逆反应方向移动因此溶液呈橙红色。
(3)向原溶液中加入Ba(NO3)2溶液,则Ba2+结合CrO42-生成BaCrO4黄色沉淀,降低CrO42-的浓度,所以平衡向正反应方向移动。由于离子的浓度降低,因此溶液颜色将变浅。
Ⅱ.(1)①由于碱能使酚酞显红色,而酸使酚酞不白色。所以用氢氧化钠溶液滴定盐酸时,滴定达到终点的现象是最后一滴氢氧化钠溶液加入,溶液由无色恰好变浅红色,且半分钟内不褪色、由于酚酞的变色范围是8.2~10.0,所以此时锥形瓶内溶液的pH范围为8.2~10.0。
(2)根据表中数据可知,三次实验中消耗氢氧化钠溶液的体积分别是22.62ml-0.10ml=22.52ml、22.58ml-0.10ml=22.48ml、22.60ml-0.10ml=22.50ml,所以三次实验中平均消耗氢氧化钠溶液的体积是
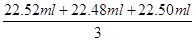 =22.50ml。因此盐酸的浓度是
=22.50ml。因此盐酸的浓度是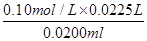 =0.1130mol/L。
=0.1130mol/L。(3)由于碱式滴定管的下面是含有玻璃球的橡胶管,因此挤压玻璃球使尖嘴部分充满碱液的正确操作是选项丙。
(4)根据
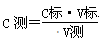 可知,由于C标、V待均为定植,所以C测的大小取决于V标的大小,即V标:偏大或偏小,则C测偏大或偏小,据此可以判断。A、滴定终点读数时俯视读数,则读数偏小,因此消耗氢氧化钠溶液的体积偏小,测定结果偏低;B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗,则盐酸被稀释,浓度降低。因此消耗氢氧化钠溶液的体积偏小,测定结果偏低;C、锥形瓶水洗后未干燥,不改变溶质的物质的量,不影响结果;D、配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中,则实际所配的氢氧化钠溶液浓度偏高。因此中和盐酸时消耗氢氧化钠溶液的体积偏小,测定结果偏低;E、配制NaOH标准溶液时,定容时仰视容量瓶的刻度线,则所配浓度偏低,所以中和盐酸时消耗氢氧化钠溶液的体积偏大,测定结果偏高;F、碱式滴定管尖嘴部分有气泡,滴定后消失,则实际消耗氢氧化钠溶液的体积偏大,测定结果偏高,所以答案选EF。
可知,由于C标、V待均为定植,所以C测的大小取决于V标的大小,即V标:偏大或偏小,则C测偏大或偏小,据此可以判断。A、滴定终点读数时俯视读数,则读数偏小,因此消耗氢氧化钠溶液的体积偏小,测定结果偏低;B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗,则盐酸被稀释,浓度降低。因此消耗氢氧化钠溶液的体积偏小,测定结果偏低;C、锥形瓶水洗后未干燥,不改变溶质的物质的量,不影响结果;D、配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中,则实际所配的氢氧化钠溶液浓度偏高。因此中和盐酸时消耗氢氧化钠溶液的体积偏小,测定结果偏低;E、配制NaOH标准溶液时,定容时仰视容量瓶的刻度线,则所配浓度偏低,所以中和盐酸时消耗氢氧化钠溶液的体积偏大,测定结果偏高;F、碱式滴定管尖嘴部分有气泡,滴定后消失,则实际消耗氢氧化钠溶液的体积偏大,测定结果偏高,所以答案选EF。
练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
 MgO(s)+CO2(g)+SO2(g) ΔH>0
MgO(s)+CO2(g)+SO2(g) ΔH>0
 2HI (g)达到平衡的标志是
2HI (g)达到平衡的标志是 cC + Q在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为( )
cC + Q在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为( ) CO(NH2)2+H2O,当氨碳比
CO(NH2)2+H2O,当氨碳比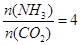 ,CO2的转化率随时间的变化关系如右图所示,下列说法错误的是( )
,CO2的转化率随时间的变化关系如右图所示,下列说法错误的是( )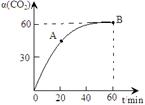
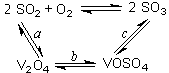
 SO3+ V2O4
SO3+ V2O4 2SO2+O2在550 ℃时的平衡常数K= 。
2SO2+O2在550 ℃时的平衡常数K= 。
 2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。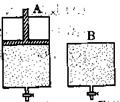
 2C(g)+xD(s)的化学平衡状态,相关数据如下:M:3 mol A 、2 mol B;2 min达平衡,生成D 1.2 mol,测得从反应开始到平衡C的速率为0.3 mol·(L·min)-1。N:2 mol C 、y mol D;达平衡时c(A)="0.6" mol·L-1。下列推断的结论中不正确的是
2C(g)+xD(s)的化学平衡状态,相关数据如下:M:3 mol A 、2 mol B;2 min达平衡,生成D 1.2 mol,测得从反应开始到平衡C的速率为0.3 mol·(L·min)-1。N:2 mol C 、y mol D;达平衡时c(A)="0.6" mol·L-1。下列推断的结论中不正确的是