��Ŀ����
����Ŀ����������п(ZnO)��������1-100 nm֮�䣬��һ������21���͵����߹��ܾ�ϸ����Ʒ�����ֳ�������������ʡ�ij�о����Դ�����п��������CuO��FeO��MnO��Fe2O3�ȣ�Ϊԭ�ϣ�����ʪ��ѧ��(NPP-��)�Ʊ�������������п����������������ͼ��

��֪��
��pH=5.4ʱ��KMnO4�Ļ�ԭ����ΪMnO2��
������ʵ�������¸����������������pH������±���ʾ��
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Mn(OH)2 | |
��ʼ������pH | 7.5 | 2.2 | 5.2 | 6.4 | 8.6 |
������ȫ��pH | 9.0 | 3.2 | 6.7 | 8.0 | 10.1 |
����������Ϣ���ش��������⣺
��1�����չ����и�������õ��ķ��뷽����_______________________________��
��2��������1������Ҫ�ɷ���______________________________________________��
��3������Ӧ��2��������������ԭ��Ӧ�����ӷ���ʽΪ_______________________________________________________________
��4�� ����Ӧ��3���м���п�۵�������________________________________��
��5������Ӧ��4���õ��ķ�Һ�У����е���Ҫ���ӳ���Na+�⣬����______________��
���𰸡� ���� Fe(OH)3 MnO4�� + 3Fe2+ + 4H+ = 3Fe3+ + MnO2��+ 2H2O��2MnO4�� +3Mn2++2H2O = 5MnO2��+ 4H+ ��ȥ��Һ��Cu2+ K+��SO42��
����������1�����⿼�����ʵij��Ӻͷ��룬�������̣�������õ�������Һ����������˷��뷽���ǹ��ˣ���2�����⿼�����ܵ�����ܽ�ƽ���Ӧ�ã���Ӧ��1���Ӵ�����п��Ŀ���ǵ���pH������4.5��5�����ݱ������ݣ�Fe3����������������ʽ����������������1ΪFe(OH)3����3�����⿼��������ԭ��Ӧ����ʽ����д�����ݴ�����п�ijɷ֣���Ӧ��1�к���Fe2������˼�����������Һ��Ŀ��֮һ�ǰ�Fe2��������Fe3����Ȼ�����pH����ȥ��������ӷ�Ӧ����ʽΪMnO4�� + 3Fe2�� + 4H�� = 3Fe3�� + MnO2��+ 2H2O�����ݴ�����п�ijɷ֣���Ӧ��1�еõ������ӻ�����Mn2������������ͼ���������Ը��������Һ��Ŀ��֮���dz�ȥMn2�������ӷ�Ӧ����ʽΪ2MnO4�� +3Mn2��+2H2O = 5MnO2��+ 4H�� ����4���������ʵij��ӣ������̵�Ŀ���ǵõ���������п�����ݷ�Ӧ��1��2����Ӧ��3��Ŀ���dz�ȥCu2����������ý�����ԣ�����Zn��Cu2��=Zn2��Cu������п��Ŀ���dz�ȥ��Һ��Cu2������5���������ӵĴ��ڣ���������ͼ����Ӧ��4�еķ�Һ�к���Na����K����SO42���ȡ�

����Ŀ����������ʵ�鷽����,���Դﵽ��Ӧʵ��Ŀ�ĵ���
A | B | C | D | |
�� �� |
|
|
|
|
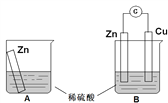
Ŀ �� | ��֤��ͬ�����Ի�ѧ��Ӧ���ʵ�Ӱ�� | �����Ҵ���ˮ | ��п�廻��ͭ�� �Ը�բ�ű���Ч������ | ��֪��Na2SiO3 + CO2 + H2O == Na2CO3 + H2SiO3�� ��֤�ǽ����ԣ�C > Si |
A. A B. B C. C D. D
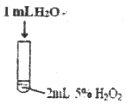
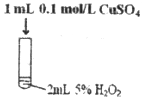
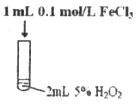
����Ŀ��ij�о�С�����������ʵ�飬̽�������´����Թ�������ֽⷴӦ��Ӱ�졣
�� | �� | �� | |
ʵ����� ʾ��ͼ |
|
|
|
ʵ������ | �м��������ݲ��� | ���������������мӿ� | ���������������Լӿ� |
��1��ʵ����������_______________��
��2��ʵ����з�Ӧ�Ļ�ѧ����ʽΪ_______________��
��3������ʵ���������IJ�ͬ�����Եó��Ľ����ǣ�
��ʹ�ú��ʵĴ����������˫��ˮ�ֽ�ķ�Ӧ���ʣ�
��_______________��
��4����һ���¶��£�10 mL 0.40 mol/L��H2O2��Һ�������ֽ⡣��ͬʱ�̲������O2�������������Ϊ��״�������±���ʾ��
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V��O2��/mL | 0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
0~6 min����H2O2��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊv��H2O2����_________mol/��L��min��������������ȷ��0.001��