题目内容
【题目】将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4·H2O。
(1)Cu2+基态核外电子排布式为________________________;[Cu(NH3)4]SO4·H2O中,不考虑空间构型,[Cu(NH3)4]2+的结构可用示意图表示为___________。
(2)乙醇分子中C原子轨道杂化类型为___________,H2O与H+以配位键形成H3O+,则H3O+的空间构型为__________(用文字描述)。
(3)N、O、S第一电离能由大到小的顺序为____________________。
(4)某含有结晶水的铜的氯化物的晶胞结构如图所示,该化合物的化学式是________。
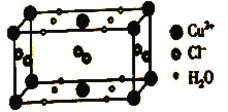
【答案】 1s22s22p63s23p63d9 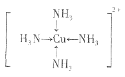 sp3 三角锥形 N>O>S CuCl2·2H2O
sp3 三角锥形 N>O>S CuCl2·2H2O
【解析】试题分析:(1)Cu2+的原子序数为27,结合能量最低原理书写电子排布式;[Cu(NH3)4]2+中Cu2+与NH3通过4个配位键结合;(2)乙醇分子中C都形成4个单键;H2O与H+以配位键形成H3O+,氧原子的价电子对数是4,有1对孤对电子;(3)同周期元素从左到右第一电离能逐渐增大,N原子2p轨道为半充满状态,第一电离能大于O;同主族元素从上到下第一电离能减小;(4)根据均摊法计算晶胞的化学式。
解析:(1)Cu2+的原子序数为27,根据能量最低原理,Cu2+的电子排布式是1s22s22p63s23p63d9;[Cu(NH3)4]2+中Cu2+与NH3通过配位键结合,[Cu(NH3)4]2+的结构可用示意图表示为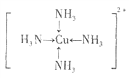 ;(2)乙醇分子中C都形成4个单键,所以C原子轨道杂化类型为sp3;H2O与H+以配位键形成H3O+,氧原子的价电子对数是4,有1对孤对电子,所以H3O+的空间构型为三角锥形;(3)同周期元素从左到右第一电离能逐渐增大,N原子2p轨道为半充满状态,第一电离能N大于O;同主族元素从上到下第一电离能减小,第一电离能O>S,所以第一电离能N>O>S;(4)根据均摊法,Cu2+数是
;(2)乙醇分子中C都形成4个单键,所以C原子轨道杂化类型为sp3;H2O与H+以配位键形成H3O+,氧原子的价电子对数是4,有1对孤对电子,所以H3O+的空间构型为三角锥形;(3)同周期元素从左到右第一电离能逐渐增大,N原子2p轨道为半充满状态,第一电离能N大于O;同主族元素从上到下第一电离能减小,第一电离能O>S,所以第一电离能N>O>S;(4)根据均摊法,Cu2+数是![]() =2,Cl-数是
=2,Cl-数是![]() ,水分子数是
,水分子数是![]() ,所以晶胞的化学式是CuCl2·2H2O。
,所以晶胞的化学式是CuCl2·2H2O。

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】某研究小组设计了如下实验,探究常温下催化剂对过氧化氢分解反应的影响。
Ⅰ | Ⅱ | Ⅲ | |
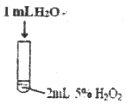
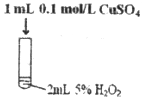
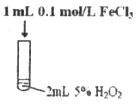
实验操作 示意图 |
|
|
|
实验现象 | 有极少量气泡产生 | 产生气泡速率略有加快 | 产生气泡速率明显加快 |
(1)实验Ⅰ的作用是_______________。
(2)实验Ⅲ中反应的化学方程式为_______________。
(3)根据实验Ⅰ~Ⅲ中现象的不同,可以得出的结论是:
①使用合适的催化剂,可提高双氧水分解的反应速率;
②_______________。
(4)在一定温度下,10 mL 0.40 mol/L,H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表所示:
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
0~6 min,以H2O2的浓度变化表示的反应速率为v(H2O2)=_________mol/(L·min)。(计算结果精确到0.001)