题目内容
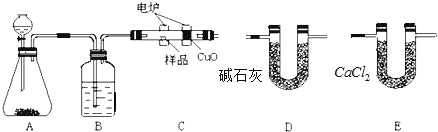
【题目】实验室用环己醇(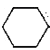 —OH)与85%磷酸在共热条件下制取环已烯(
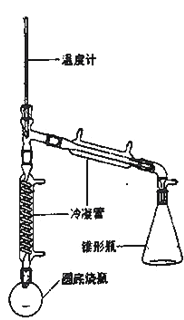
—OH)与85%磷酸在共热条件下制取环已烯(![]() ),制备装置如图所示。
),制备装置如图所示。
实验药品的物理性质:
名称 | 密度(g/mL) | 熔点℃ | 沸点℃ | 溶解性 |
环己醇 | 0.96 | 25.2 | 161 | 微溶于水 |
环己烯 | 0.81 | -103 | 83 | 不溶于水 |
85% H3PO4 | 1.68 | 42.35 | 213(失水) | 易溶于水 |
已知:环己醇能与水形成二元共沸物(含水80%),其沸点为97.8℃
实验原理:
(1)该实验的反应原理与实验室制乙烯相似,请用化学方程式表示______。
(2)该反应有副反应发生(产物为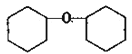 ),反应的方程式为____。
),反应的方程式为____。
II.制备粗产品:
(3)在圆底烧瓶中加入20mL(9.6g)环己醇、10mL 85% H3PO4几粒碎瓷片,用电热包均匀缓慢加热。温度计的温度不应超过90℃,原因是____;85% H3PO4在反应中的作用是____;碎瓷片的作用是_____。
Ⅲ.粗产品提纯
(4)从分液漏斗中分离出来的环己烯还要转移到蒸馏烧瓶中,并加入少量的无水氯化钙进一步蒸馏,此时温度计下端的水银球应插在蒸馏烧瓶的_____位置,温度计显示的温度应为_____。
【答案】![]() —OH
—OH![]()
![]() +H2O
+H2O ![]() —OH
—OH![]()
![]() —O—
—O—![]() +H2O 防止环己醇挥发出来(或提高反应物环己醇的转化率) 催化剂、脱水剂 防止暴沸 支管口处 83℃
+H2O 防止环己醇挥发出来(或提高反应物环己醇的转化率) 催化剂、脱水剂 防止暴沸 支管口处 83℃
【解析】
I(1).实验室制乙烯是由乙醇和浓硫酸在170度反应制得,发生消去反应,该实验的反应原理与实验室制乙烯相似,则正确的化学方程式为![]() —OH
—OH![]()
![]() +H2O,
+H2O,
答案为:![]() —OH
—OH![]()
![]() +H2O;
+H2O;
(2).该反应有副反应发生,醇和醇脱水缩合会生成醚,![]() —OH
—OH![]()
![]() —O—
—O—![]() +H2O;
+H2O;
答案为:![]() —OH
—OH![]()
![]() —O—
—O—![]() +H2O;
+H2O;
II(3).加入10mL 85% H3PO4能吸水,H3PO4是常见的脱水剂和催化剂;几粒碎瓷片,是为了防止暴沸 ,用电热包均匀缓慢加热;温度计的温度不应超过90℃是因为环己醇的沸点比较低,如果温度太高,超过90度,会使原料和产物一起蒸出,从而降低反应物环己醇的转化率;
答案为:防止环己醇挥发出来(或提高反应物环己醇的转化率;催化剂、脱水剂;防止暴沸;
(4)从分液漏斗中分离出来的环己烯还要转移到蒸馏烧瓶中,环己烯的沸点是83℃,要分开环己烯和水,无水氯化钙是常用的干燥剂,要加入少量的无水氯化钙进一步蒸馏除去水,此时温度计下端的水银球应插在蒸馏烧瓶的支管口处;
答案为:支管口处;83℃。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】Ⅰ.在测定空气里氧气含量的实验中,小明采用了如图所用的装置:
装置一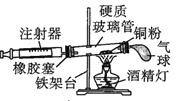 装置二
装置二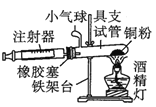
在由注射器和硬质玻璃管组成的密闭系统中留有40mL空气,给装有铜粉的玻璃管加热,观察密闭系统内空气体积变化。
(1)在实验加热过程中,缓慢推动注射器活塞的目的是__________。
(2)装置一比装置二更______(填“合理”或“不合理”),理由是_________。
(3)小明测得的实验结果如下:
反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
15mL | 10mL |
由此数据可推算出他测定的氧气的体积分数________21%(填“>”“<”或“=”),造成该实验出现误差的原因可能是____________(填序号)。
①推动注射器活塞速度太快 ②未冷却至室温就读数 ③加入铜粉量太少
Ⅱ.H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。
图甲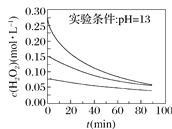 图乙
图乙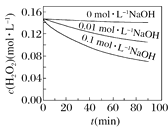
(4)根据上图,将不同条件对速率的影响情况补充完整:图甲表明,____________,H2O2分解速率越快;图乙表明,_________,H2O2分解速率越快。