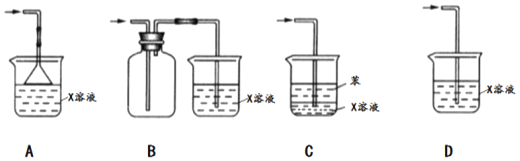
题目内容
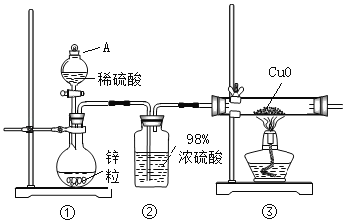
【题目】实验室用浓盐酸和![]() 制
制![]() ,并以干燥的
,并以干燥的![]() 为原料进行实验,装置如下图所示。
为原料进行实验,装置如下图所示。
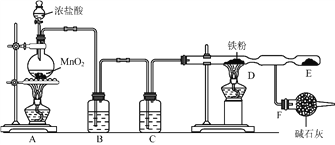
⑴装置![]() 烧瓶中发生反应的化学方程式为:_________________________________。
烧瓶中发生反应的化学方程式为:_________________________________。
⑵装置![]() 、
、![]() 中应盛放的试剂名称分别为__________、_________;从
中应盛放的试剂名称分别为__________、_________;从![]() 装置导出的气体若不经过
装置导出的气体若不经过![]() 、
、![]() 装置而直接进入
装置而直接进入![]() 管,将对实验产生的不良后果是___________________________。
管,将对实验产生的不良后果是___________________________。
⑶实验时,先点燃![]() 处的酒精灯,让氯气充满装置,再点燃
处的酒精灯,让氯气充满装置,再点燃![]() 处酒精灯,写出
处酒精灯,写出![]() 中反应的化学方程式:_________________________________________。
中反应的化学方程式:_________________________________________。
⑷![]() 装置所起的作用是____________________,____________________。
装置所起的作用是____________________,____________________。
⑸用廉价的石灰乳吸收氯气可制得漂粉精,写出工业制漂粉精反应的化学方程式:
___________________________________________________________________。
【答案】 MnO2+4HCl(浓) → MnCl2+Cl2 ↑ +2H2O 饱和食盐水 浓硫酸 铁粉会与氯化氢、水反应生成氢气,易发生爆炸,防止生成氯化亚铁。(答案合理就给分) 2Fe+3Cl2 → 2FeCl3 吸收未反应的氯气,以免污染空气 防止空气中的水蒸气进入E中 2Cl2+2Ca(OH)2 → CaCl2+Ca(ClO)2+2H2O
【解析】(1)A装置烧瓶中发生制备氯气的反应,反应的化学方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2 ↑+2H2O。(2)生成的氯气中含有氯化氢和水蒸气,与铁反应时需要净化氯气,因此装置B、C中应盛放的试剂名称分别为饱和食盐水、浓硫酸;铁是活泼的金属,能与盐酸、水蒸气反应生成可燃性气体氢气,因此从A装置导出的气体若不经过B、C装置而直接进入D管,将对实验产生的不良后果是铁粉会与氯化氢、水反应生成氢气,易发生爆炸,防止生成氯化亚铁。(3)加热时铁和氯气化合生成氯化铁,反应的化学方程式为2Fe+3Cl2
MnCl2+Cl2 ↑+2H2O。(2)生成的氯气中含有氯化氢和水蒸气,与铁反应时需要净化氯气,因此装置B、C中应盛放的试剂名称分别为饱和食盐水、浓硫酸;铁是活泼的金属,能与盐酸、水蒸气反应生成可燃性气体氢气,因此从A装置导出的气体若不经过B、C装置而直接进入D管,将对实验产生的不良后果是铁粉会与氯化氢、水反应生成氢气,易发生爆炸,防止生成氯化亚铁。(3)加热时铁和氯气化合生成氯化铁,反应的化学方程式为2Fe+3Cl2 ![]() 2FeCl3。(4)氯气是大气污染物,因此装置F所起的作用是吸收未反应的氯气,以免污染空气,同时还防止空气中的水蒸气进入E中。(5)石灰乳和氯气反应制漂粉精的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
2FeCl3。(4)氯气是大气污染物,因此装置F所起的作用是吸收未反应的氯气,以免污染空气,同时还防止空气中的水蒸气进入E中。(5)石灰乳和氯气反应制漂粉精的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。

【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。表列出了有关物质的部分物理性质,请回答:
)等产品。表列出了有关物质的部分物理性质,请回答:
名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度 (ρ水=1g/cm3) | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
 (1)装置a的名称是______________。
(1)装置a的名称是______________。
(2)三颈瓶中发生反应的化学方程式为_______________________________________。
(3)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是_____________________________________________。
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过_____、_____(填操作名称)等操作,才能得到苯甲醛粗产品。
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是_______(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合振荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为_____。(苯甲酸相对分子质量:122.0)
【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)N2(g)+3H2(g)2NH3(g) △H<0,研究表明金属催化剂可加速氨气的合成。下表为某温度下等质量的不同金属分别催化合成氨气时,氢气的初始速率(mmol min-1)。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①不同催化剂存在下,合成氨气反应的活化能最大的是_______ (填写催化剂的化学式)。
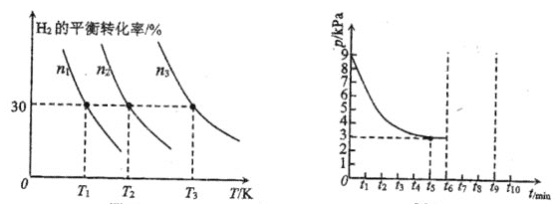
②某研究小组进一步探究催化剂对合成氨气的影响。将N2和H2以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NH3含量,如下图,从而确定温度对催化剂的影响。a点___ (填“是”或“不是”)对应温度下氨气平衡时的百分含量,说明其理由___。

(2)氨气的分解反应2NH3N2+3H2 △H<0,,在实际生产中往刚性容器中同时通入氨气和水蒸气,测得容器总压和氨气转化率随时间变化结果如图所示。
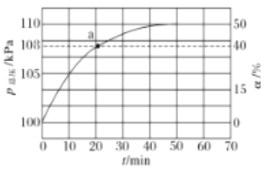
①平衡时,p(H2O)= ___kPa,平衡常数Kp=_____KPa2(Kp为以分压表示的平衡常数)。
②反应速率v=v正-v逆=K正p2(NH3)-K逆p(N2)p3(H2),k正、k逆分别为正、逆反应速率常数。计算a处的![]() =__。
=__。
(3)液氨中,2NH3(l)NH2-+NH4+,用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应______。
(4)在室温下用氨水吸收SO2。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的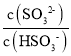 =____。(已知25℃,Kb(NH3H2O)=1.810-5;Ka1(H2SO3)=.310-2,Ka2(H2SO3)=6.210-8)
=____。(已知25℃,Kb(NH3H2O)=1.810-5;Ka1(H2SO3)=.310-2,Ka2(H2SO3)=6.210-8)
【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.158 | 158 |
硝酸银 | 0.04 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是__________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸
(2)在溶液配制过程中,下列操作正确且对配制结果没有影响的是__________。
A.将药品放入容量瓶中加蒸馏水溶解
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(3)配制上述500mL“鲜花保鲜剂”所需的玻璃仪器有:烧杯、玻璃棒、_____________、__________。(在横线上填写所缺仪器的名称)
(4)鲜花保鲜剂中K+(蔗糖、阿司匹林中不含K+) 的物质的量浓度为______mol/L。