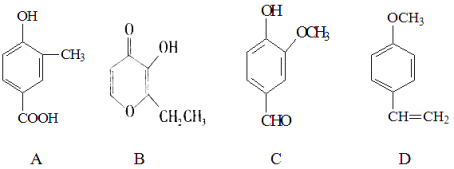
题目内容
【题目】实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
步骤1:向废液中加入足量的NaCl溶液,将所得沉淀过滤,并洗涤干净。
步骤2:将沉淀放入烧杯,并放入铝片,再加入20%的Na2CO3溶液至浸没固体,加热搅拌,至沉淀变为灰白色[含有Ag、Al(OH)3和少量仍未反应的AgCl]。取出铝片,过滤并洗涤沉淀。
步骤3:……
(1)步骤1中检验所加NaCl溶液已经足量的方法是________________。
(2)步骤2加热时还产生能使澄清石灰水变浑浊的气体。写出该过程中发生反应的离子方程式:________________________________。
加入足量稀盐酸,充分反应后,过滤;洗涤沉淀,向沉淀中加入足量稀硝酸,充分反应后,过滤;将所得滤液蒸发浓缩、冷却结晶,过滤;用冰水洗涤、干燥,得到硝酸银晶体(实验中必须使用的试剂有:稀盐酸、稀硝酸、冰水)。
(3)已知:Ag++SCN-=AgSCN↓(白色)。实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应):
①称取2.000g制备的硝酸银样品,加水溶解,定容到100mL。溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有_________。
②准确量取25.00mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.1000 mol·L-1NH4SCN标准溶液滴定。滴定终点的实验现象为________。
③重复②的操作两次,所用NH4SCN标准溶液的平均体积为29.00mL。则硝酸银的质量分数为_____。
【答案】静置,向上层清液中继续滴加NaCl溶液,若溶液不变浑浊,则NaCl已足量 2Al+6AgCl+3CO32-+3H2O=2Al(OH)3+6Ag+6Cl-+3CO2↑ 100mL容量瓶、胶头滴管 溶液变为(血)红色 98.60%
【解析】
(1)加足量NaCl的溶液后不含Ag+;
(2)步骤2中铝置换出氯化银中的银,铝离子与CO32-发生双水解反应生成氢氧化铝和二氧化碳;
(3)①根据配制一定物质的量浓度的溶液分析;
②酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂, NH4SCN先与Ag+反应生成AgSCN沉淀,再与NH4Fe(SO4)2溶液反应;
③根据Ag++SCN-=AgSCN↓计算硝酸银的质量分数。
(1)加足量NaCl的溶液后不含Ag+,所以检验步骤1中所加NaCl溶液已经足量的方法是:静置,向上层清液中继续滴加NaCl溶液,若溶液不变浑浊,则NaCl已足量;
(2)步骤2中铝置换出氯化银中的银,铝离子与CO32-发生双水解反应生成氢氧化铝和二氧化碳,反应方程式是2Al+6AgCl+3CO32-+3H2O=2Al(OH)3+6Ag+6Cl-+3CO2↑;
(3)①称取2.000g制备的硝酸银样品,加水溶解,定容到100mL。所用的玻璃仪器除烧杯、玻璃棒外还有100mL容量瓶、胶头滴管;
②酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,用0.1000 mol·L-1NH4SCN标准溶液滴定, NH4SCN先与Ag+反应生成AgSCN沉淀,再与NH4Fe(SO4)2溶液变红色,滴定终点的现象是溶液变为(血)红色;
③设AgNO3的质量是xg;
Ag NO3+NH4SCN=AgSCN↓+ NH4NO3
170g 1mol
Xg 0.1 mol·L-1×0.029L
![]() , x =0.493g;硝酸银的质量分数为
, x =0.493g;硝酸银的质量分数为![]() 98.60%。
98.60%。

【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
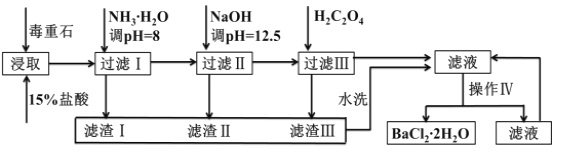
Ca2+ | Mg2+ | Fe3+ | ||
开始沉淀的pH | 11.9 | 9.1 | 1.9 | |
完全沉淀的pH | 13.9 | 11.1 | 3.2 | |
已知:室温条件下BaC2O4和CaC2O4均为沉淀,但BaC2O4的溶解度相对较大
(1)实验室用37%的盐酸配制1mol/L盐酸,下列仪器中,不需要使用的是_____
a.容量瓶 b.量筒 c.烧杯d.滴定管
(2)为了加快毒重石的酸浸速率,可以采取的措施有________________________(至少两条)。
(3)加入氨水调节溶液pH=8的目的是__________________。滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________________________________。
(4)操作Ⅳ的步骤是:___________、___________、过滤。