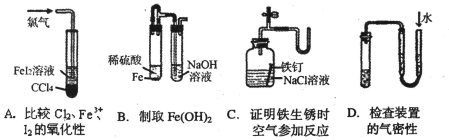
题目内容
5.已知某元素的阳离子R2+的核内中子数为n,质量数为A,则mg它的氧化物中所含电子的物质的量是( )| A. | $\frac{m}{A+16}$(A-n+8)mol | B. | $\frac{m}{A+16}$(A-n+10)mol | C. | (A-n+2)mol | D. | $\frac{m}{A+16}$(A-n+6)mol |
分析 核内中子数为N的R2+离子,质量数为A,所以质子数为A-n,该离子的相对原子质量在数值上等于其质量数;该离子带2个单位正电荷,所以其氧化物的化学式为RO;该氧化物的摩尔质量为(A+16)g/mol,一个氧化物分子中含有(A-n+8)个电子.
解答 解:该氧化物的摩尔质量为(A+16)g/mol,m g 它的氧化物的物质的量为$\frac{m}{A+16}$mol;
一个氧化物分子中含有(A-n+8)个电子,所以ng 它的氧化物中所含电子的物质的量为$\frac{m}{A+16}$×(A-n+8)mol,
故选A.
点评 本题考查质子数、中子数、质量数之间的关系及物质的量的相关计算,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
16.下列有关物质结构的说法正确的是( )
| A. | 78gNa2O2晶体中所含离子数约为1.806×1024 | |
| B. | 4.48L氨气分子中含0.6NA个N-H键 | |
| C. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| D. | N2H4分子中极性键和非极性键的比值为1:4 |
13.在25℃时,电解含有0.02mol CuSO4和0.04mol NaCl的混合溶液200mL,当阳极产生672mL(标准状况下)气体时,假设忽略溶液体积变化,则电解后溶液的pH为( )
| A. | 1 | B. | 2 | C. | 6 | D. | 7 |
20.下列各组中的性质比较,正确的是( )
①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③还原性:F->C1->Br-
④稳定性:HCl>H2S>PH3
⑤熔沸点:HI>HBr>HCl>HF.
①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③还原性:F->C1->Br-
④稳定性:HCl>H2S>PH3
⑤熔沸点:HI>HBr>HCl>HF.
| A. | ①②④ | B. | ①②③ | C. | ②③④ | D. | ①②④⑤ |
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
14.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 5.6g Fe和足量的盐酸反应时,失去的电子数为0.3NA | |
| B. | 1 mol Na2O2固体中含离子总数为3NA | |
| C. | 标准状况下,22.4 L SO3所含分子数为NA | |
| D. | 0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA |
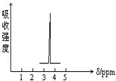 化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:CH2BrCH2Br,预测B的核磁共振氢谱上有2个峰.
化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:CH2BrCH2Br,预测B的核磁共振氢谱上有2个峰. 实验目的的是
实验目的的是