题目内容
13.在25℃时,电解含有0.02mol CuSO4和0.04mol NaCl的混合溶液200mL,当阳极产生672mL(标准状况下)气体时,假设忽略溶液体积变化,则电解后溶液的pH为( )| A. | 1 | B. | 2 | C. | 6 | D. | 7 |
分析 结合2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,阳极生成的气体为氧气、氯气,根据离子的放电顺序可知,先生成氯气,结合电子守恒来计算.
解答 解:电解含有0.02molCuSO4和0.04molNaCl的混合溶液200mL,阳极上先生成氯气后生成氧气,阴极上先生成铜,后生成氢气,阳极上氯气完全析出时,氯气的体积为:$\frac{0.04mol}{2}$×22.4L/mol=0.448L=448mL<672mL,
所以阳极上还有224mL氧气,阳极上转移电子的物质的量为:0.04mol×1+$\frac{0.224L}{22.4L/mol}$×4=0.08mol,
阴极上铜完全析出时,需要电子的物质的量为:0.02mol×2=0.04mol,
生成224mL氧气时,相当于电解硫酸钠溶液,电解后溶液为中性,则溶液的pH=7,
故选D.
点评 本题考查了电解原理、溶液pH的计算,题目难度中等,明确电解原理及生成气体的组成为解答关键,注意掌握溶液酸碱性与溶液pH的计算方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.某非金属元素X的最高化合价为+m,其最高价氧化物的水化物的分子中有b个氧原子,则该元素氢化物的分子式为( )
| A. | Hm+2bX | B. | Hm-2bX | C. | Hm-8X | D. | H8-mX |
4.化学与环境密切相关,下列说法不正确的是( )
| A. | 二氧化碳是形成酸雨的主要物质 | |
| B. | 随意丢弃废电池会对生态环境造成危害 | |
| C. | 任意排放工业废水会导致土壤和水源的污染 | |
| D. | 燃煤时加入适量的石灰可减少二氧化硫的排放 |
8.钢铁生锈过程发生如下反应:下列说法正确的是( )
①2Fe+O2+2H2O═2Fe(OH)2;
②4Fe(OH)2+O2+2H2O═4Fe(OH)3;
③2Fe(OH)3═Fe2O3+3H2O.
①2Fe+O2+2H2O═2Fe(OH)2;
②4Fe(OH)2+O2+2H2O═4Fe(OH)3;
③2Fe(OH)3═Fe2O3+3H2O.
| A. | 当参加反应的O2等物质的量时,反应①、②中电子转移数目相等 | |
| B. | 反应①中氧化剂是氧气和水 | |
| C. | 与铜质水龙头连接处的钢质水管不易发生腐蚀 | |
| D. | 钢铁在潮湿的空气中不能发生电化学腐蚀 |
18.下列分子中,所有原子都满足最外层为 8 电子结构的是( )
| A. | BF3 | B. | NF3 | C. | NH3 | D. | PCl5 |
5.已知某元素的阳离子R2+的核内中子数为n,质量数为A,则mg它的氧化物中所含电子的物质的量是( )
| A. | $\frac{m}{A+16}$(A-n+8)mol | B. | $\frac{m}{A+16}$(A-n+10)mol | C. | (A-n+2)mol | D. | $\frac{m}{A+16}$(A-n+6)mol |
19.如图是氯气的制备以及氯、溴、碘的非金属性比较实验,充分反应一段时间后,打开装置D的活塞,将装置D中少量溶液加入装置E中,振荡,观察实验现象,下列说法正确的是( ) 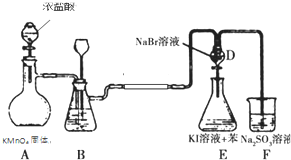

| A. | F2不能与NaCl溶液反应置换出氯气 | |
| B. | 装置B中可盛放水吸收氯气中的HCl气体 | |
| C. | 装置E下层呈现紫红色 | |
| D. | 装置E中有机试剂层呈现紫红色,能说明非金属性Br>I |
 Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如下图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如下图所示,下列叙述正确的是
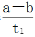 mol·L-1·min-1
mol·L-1·min-1