题目内容
20.下列各组中的性质比较,正确的是( )①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③还原性:F->C1->Br-
④稳定性:HCl>H2S>PH3
⑤熔沸点:HI>HBr>HCl>HF.
| A. | ①②④ | B. | ①②③ | C. | ②③④ | D. | ①②④⑤ |
分析 ①元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
②元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
③元素的非金属性越强,对应阴离子的还原性越弱;
④元素的非金属性越强,对应的氢化物越稳定;
⑤分子晶体相对分子量越大熔沸点越高,分子间存在氢键的物质熔沸点异常高.
解答 解:①非金属性:Cl>Br>I,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故①正确;
②金属性:Ba>Ca>Mg,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,故②正确;
③非金属性F>Cl>Br,元素的非金属性越强,对应阴离子的还原性越弱,故③错误.
④非金属性Cl>S>P,元素的非金属性越强,对应的氢化物越稳定,故④正确;
⑤氟化氢分子之间存在氢键,所以熔沸点:HF>HI>HBr>HCl,故⑤错误;
故选A
点评 本题考查元素周期律知识,为高频考点,侧重于学生的分析能力的考查,注意把握判断的角度,注重相关基础知识的积累,难度不大.

| A. | 由乙炔制氯乙烯;甲烷与氯气在光照条件下反应 | |
| B. | 溴乙烷和氢氧化钠乙醇溶液共热;乙醇制得乙烯 | |
| C. | 乙烯使溴的四氯化碳溶液褪色;乙烯使酸性高锰酸钾溶液褪色 | |
| D. | 溴乙烷和氢氧化钠溶液共热;乙烯和氢气反应 |
①2Fe+O2+2H2O═2Fe(OH)2;
②4Fe(OH)2+O2+2H2O═4Fe(OH)3;
③2Fe(OH)3═Fe2O3+3H2O.
| A. | 当参加反应的O2等物质的量时,反应①、②中电子转移数目相等 | |
| B. | 反应①中氧化剂是氧气和水 | |
| C. | 与铜质水龙头连接处的钢质水管不易发生腐蚀 | |
| D. | 钢铁在潮湿的空气中不能发生电化学腐蚀 |
| A. | $\frac{m}{A+16}$(A-n+8)mol | B. | $\frac{m}{A+16}$(A-n+10)mol | C. | (A-n+2)mol | D. | $\frac{m}{A+16}$(A-n+6)mol |
| A. | 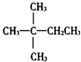 | B. | CH3CH2CH2CH2CH3 | C. | 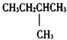 | D. |  |
某化学研究性学习小组拟对一种焰火原料(由两种短周期的常见金属单质组成的合金粉末)进行探究。请完成下列探究报告。
 【探究目的】探究该焰火原料的组成
【探究目的】探究该焰火原料的组成
 【资料检索】①Mg2+检验方法:取2滴待检液,加入2滴2mol·L-1NaOH溶液,再加入1滴镁试剂(Ⅰ)染料(
【资料检索】①Mg2+检验方法:取2滴待检液,加入2滴2mol·L-1NaOH溶液,再加入1滴镁试剂(Ⅰ)染料( 对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+。Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+检出②Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵③很多合金是金属互化物,有确定的化学组成
对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+。Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+检出②Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵③很多合金是金属互化物,有确定的化学组成
【探究思路】①确定焰火原料所含金属种类;②测定焰火原料的化学式
【实验探究】
(1)甲同学进行了初步试验,实验步骤和实验现象如下。请填写下表。
试验序号 | 实验步骤 | 实验现象 | 结论 |
① | 取少量该焰火原料加入冷水 | 无明显现象 | ________________ |
② | 取少量该焰火原料加入稀盐酸 | 完全溶解,有大量气体 | _________________ |
(2)乙同学取甲第②组实验的溶液,加入镁试剂(Ⅰ)染料,得出合金中不含镁。
乙的结论________________(选填“正确”或“错误”)。判断理由为。
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下。
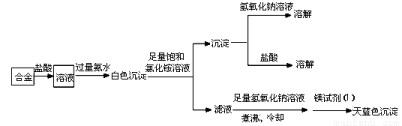
 由丙的实验记录可知,该焰火原料是由_______和_________两种金属组成的合金;实验中滤液加入足量氢氧化钠溶液后需煮沸,煮沸的理由是______________________________。
由丙的实验记录可知,该焰火原料是由_______和_________两种金属组成的合金;实验中滤液加入足量氢氧化钠溶液后需煮沸,煮沸的理由是______________________________。
(4)丁同学利用丙同学的结论,设计如下图所示的实验步骤,确定合金组成。

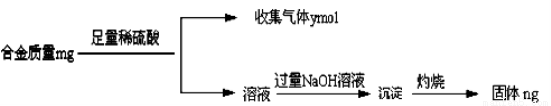
问题讨论:
①能确定合金组成的数据组有______________(填写选项字母);
A.m、n
B.m、y
C.n、y
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol,试在下图中作出y随x变化的曲线;

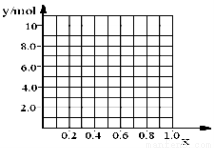
③当y=8.5mol时,该合金是一种金属互化物,其化学式为________________
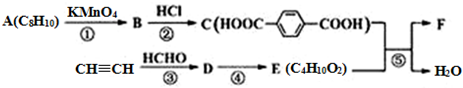
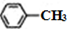 $\stackrel{KMnO_{4}}{→}$
$\stackrel{KMnO_{4}}{→}$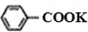
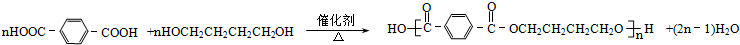 .
.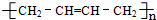
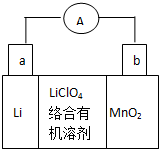 锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,
锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中, CO(g)+H2(g)当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g)当增加反应物物质的量时,平衡一定向正反应方向移动