题目内容
14.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 5.6g Fe和足量的盐酸反应时,失去的电子数为0.3NA | |
| B. | 1 mol Na2O2固体中含离子总数为3NA | |
| C. | 标准状况下,22.4 L SO3所含分子数为NA | |
| D. | 0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA |
分析 A、铁与盐酸反应生成盐酸亚铁和氢气,铁由0价升高为+2价,据此计算铁失去的电子的物质的量;
B、Na2O2固体中含2个钠离子和1个过氧根;
C、标况下,三氧化硫为固体;
D、溶液的体积不明确.
解答 解:A、5.6g铁的物质的量为0.1mol,铁与盐酸反应生成硫酸亚铁和氢气,铁由0价升高为+2价,转移的电子数为0.1mol×2×NAmol-1=0.2NA,故A错误;
B、Na2O2固体中含2个钠离子和1个过氧根,故1mol过氧化钠中含3mol离子,故B正确;
C、标况下,三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、溶液的体积不明确,故溶液中氯离子的个数无法计算,故D错误.
故选B.
点评 本题考查了物质的量的有关计算,掌握公式的运用以及物质的状态是解题关键,难度不大.

练习册系列答案
相关题目
7.C5H12有3种不同结构:甲CH3(CH2)3CH3,乙CH3CH(CH3)CH2CH3,丙C(CH3)4.下列相关叙述正确的是( )
| A. | 甲、乙、丙属同系物均可与氯气、溴蒸气发生取代反应 | |
| B. | C5H12表示一种纯净物 | |
| C. | 甲、乙、丙中,丙的沸点最低 | |
| D. | 乙有3种不同沸点的二氯取代物 |
8.钢铁生锈过程发生如下反应:下列说法正确的是( )
①2Fe+O2+2H2O═2Fe(OH)2;
②4Fe(OH)2+O2+2H2O═4Fe(OH)3;
③2Fe(OH)3═Fe2O3+3H2O.
①2Fe+O2+2H2O═2Fe(OH)2;
②4Fe(OH)2+O2+2H2O═4Fe(OH)3;
③2Fe(OH)3═Fe2O3+3H2O.
| A. | 当参加反应的O2等物质的量时,反应①、②中电子转移数目相等 | |
| B. | 反应①中氧化剂是氧气和水 | |
| C. | 与铜质水龙头连接处的钢质水管不易发生腐蚀 | |
| D. | 钢铁在潮湿的空气中不能发生电化学腐蚀 |
5.已知某元素的阳离子R2+的核内中子数为n,质量数为A,则mg它的氧化物中所含电子的物质的量是( )
| A. | $\frac{m}{A+16}$(A-n+8)mol | B. | $\frac{m}{A+16}$(A-n+10)mol | C. | (A-n+2)mol | D. | $\frac{m}{A+16}$(A-n+6)mol |
19.如图是氯气的制备以及氯、溴、碘的非金属性比较实验,充分反应一段时间后,打开装置D的活塞,将装置D中少量溶液加入装置E中,振荡,观察实验现象,下列说法正确的是( ) 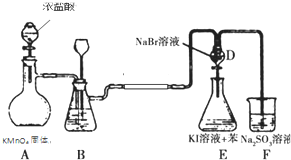

| A. | F2不能与NaCl溶液反应置换出氯气 | |
| B. | 装置B中可盛放水吸收氯气中的HCl气体 | |
| C. | 装置E下层呈现紫红色 | |
| D. | 装置E中有机试剂层呈现紫红色,能说明非金属性Br>I |
6.1mol某烃在氧气中充分燃烧,需要消耗氧气179.2L(标准状况下).它在光照的条件下与氯气反应能生成三种不同的一氯取代物.该烃的结构简式是( )
| A. | 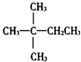 | B. | CH3CH2CH2CH2CH3 | C. | 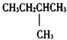 | D. |  |
3.6g某金属跟足量盐酸反应产生0.5g氢气,生成的+2价金属氯化物中共有11.5 mol电子,则该金属在元素周期表中的位置是( )
| A. | 第二周期ⅡA族 | B. | 第三周期ⅡA族 | C. | 第三周期ⅢA族 | D. | 第二周期ⅢA族 |
 CO(g)+H2(g)当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g)当增加反应物物质的量时,平衡一定向正反应方向移动