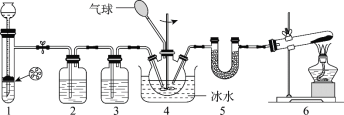
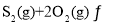题目内容
【题目】图为用惰性电极电解制备高锰酸钾的装置示意图如下。下列说法正确的是
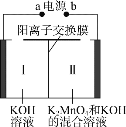
A.a为电源正极
B.Ⅰ中的K+通过阳离子交换膜移向Ⅱ
C.若不使用离子交换膜,KMnO4的产率可能会降低
D.若阴极产生0.2 mol气体,理论上可得到0.2 mol KMnO4
【答案】C
【解析】
实验目的是制备高锰酸钾,所以K2MnO4应失电子转化为KMnO4,b为正极,a为负极。在阴极,2H2O+2e-==2OH-+H2↑;在阳极,2![]() -2e- ==2
-2e- ==2![]() 。
。
A.由以上分析知,a为电源负极,A不正确;
B.在电解池中,阳离子向阴极移动,所以Ⅱ中的K+通过阳离子交换膜移向Ⅰ,B不正确;
C.若不使用离子交换膜,Ⅱ中因阳离子所带正电荷总数多于阴离子所带的负电荷总数,而使电解反应难以持续进行,从而造成KMnO4的产率降低,C正确;
D.若阴极产生0.2 mol气体,则转移电子0.4mol,理论上可得到0.4 mol KMnO4,D不正确;
故选C。

【题目】从下列实验事实所得出的相应结论不正确的是( )
选项 | 实验事实 | 结论 |
A | 其他条件不变,0.01mol·L-1的酸性KMnO4溶液分别与0.1mol·L-1的H2C2O4溶液和0.2mol·L-1的H2C2O4溶液反应,后者退色时间短 | 当其他条件不变时,增大反应物浓度可以使化学反应速率加快 |
B | 其他条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和硫酸溶液的混合液放在冷水和热水中,放在热水中的混合液先出现浑浊 | 当其他条件不变时,反应体系的温度越高,化学反应速率越快 |
C | 一定条件下,分别在容积为1L和容积为2L的两个密闭容器中加入等量的氢气和碘蒸气,相同温度下发生如下反应:H2(g)+I2(g) | 当其他条件不变时,纯气态反应体系的压强越大,化学反应速率越快 |
D | 将少量MnO2粉末加入盛有10%H2O2溶液的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生变化 | 催化剂虽然可以加快化学反应的速率,但一定不参与化学反应 |
A.AB.BC.CD.D
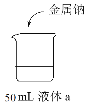
【题目】研究金属钠的性质,实验如下:
实验装置 | 实验方案 | |
液体a | 现象 | |
| 蒸馏水 | I.钠浮在水面,剧烈反应,有少量白雾 |
0.1 mol·L-1盐酸 | II.钠浮在液面,反应比Ⅰ剧烈,有白雾产生 | |
浓盐酸 | III.钠浮在液面,反应比Ⅰ缓慢,产生大量白雾,烧杯底部有白色固体 | |
下列说法不正确的是
A.II中反应的离子方程式为2Na + 2H+ === 2Na+ + H2↑
B.对比I、II、III可知,随着c(H+) 增大,反应的剧烈程度增大
C.实验I、II、III均有白雾产生,说明Na与水或酸反应均放出大量热
D.推测III中浓盐酸的c(Cl-)以及生成的NaCl固体对反应剧烈程度有影响