题目内容
9. 二甲醚(CH3OCH3)是一种重要的精细化工产品,被认为是二十一世纪最有潜力的燃料,已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)△H=-1455KJ/mol.工业上制备二甲醚的主要方法经历了三个阶段:
二甲醚(CH3OCH3)是一种重要的精细化工产品,被认为是二十一世纪最有潜力的燃料,已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)△H=-1455KJ/mol.工业上制备二甲醚的主要方法经历了三个阶段:①甲醇液体在浓硫酸作用下或甲醇气体在催化作用下直接脱水制二甲醚:2CH3OH?CH3OCH3+H2O
②合成气CO与H2直合成二甲醚:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-247kJ/mol
③天然气与水蒸气反应制备二甲醚.以CH4和H20为原料制备二甲醚和甲醇工业流程如下:

(1)写出CO(g)、H2(g)、O2(g)反应生成CO2(g)和H2O(1)的热化学方程式CO(g)+H2(g)+O2(g)=CO2(g)+H2O(1)△H=-567.3kJ/mol(计算结果保留一位小数).
(2)在反应室2中,一定条件下发生反应3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是AD(填序号).
A.低温高压 B.加催化剂 C.增加CO浓度 D.分离出二甲醚
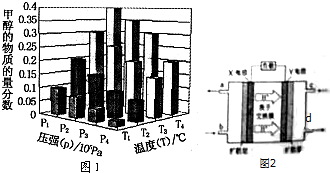
(3)在反应室3中,在一定温度和压强条件下发生了反应:3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H<0,反应达到平衡时,改变温度(T)和压强(P),反应混合物中CH3OH的物质的量分数变化情况如图1所示,关于温度(T)和压强(P)的关系判断正确的是CD(填序号).
A.P3>P2 T3>T2 B.P2>P4 T4>T2 C.P1>P3 T1>T3 D.P1>P4 T2>T3
(4)如图为绿色电源“二甲醚-氧气燃料电池”的工作原理示意图2.则X电极的反应式为:CH3OCH3-12e-+3H2O=2CO2+12H+.
分析 (1)根据盖斯定律已知①CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)△H=-1455KJ/mol;
②3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-247kJ/mol,反应CO(g)+H2(g)+O2(g)=CO2(g)+H2O(1)可以是$\frac{1}{3}$(①+②)得到,来计算并书写即可;
(2)A.低温高压均能使得化学平衡正向移动,可以提高CO的转化率;
B.加催化剂,不会改变转化率;
C.增加CO浓度,会使其转化率减小;
D.分离出二甲醚,能使得化学平衡正向移动,可以提高CO的转化率;
(3)对于反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H<0,压强越大,甲醇的物质的量分数则越大,温度越高,甲醇的物质的量分数越小,由此分析解题;
(4)根据燃料电池的工作原理以及电极反应式的书写方法来回答判断.
解答 解:(1)已知①CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)△H=-1455KJ/mol;
②3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-247kJ/mol,
反应CO(g)+H2(g)+O2(g)=CO2(g)+H2O(1)可以是$\frac{1}{3}$(①+②)得到,所以△H=-567.3kJ/mol,
故答案为:CO(g)+H2(g)+O2(g)=CO2(g)+H2O(1)△H=-567.3kJ/mol;
(2)A.低温高压均能使得化学平衡正向移动,可以提高CO的转化率,故A正确;
B.加催化剂,不会改变转化率,故B错误;
C.增加CO浓度,会使其转化率减小,故C错误;
D.分离出二甲醚,能使得化学平衡正向移动,可以提高CO的转化率,故D正确;
故选AD;
(3)对于反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H<0,压强越大,甲醇的物质的量分数则越大,温度越高,甲醇的物质的量分数越小,所以P1>P3、T1>T3,P1>P4、T2>T3,故答案为:CD;
(4)燃料电池中,通入燃料二甲醚的电极X是负极,该极上发生失电子的氧化反应,即CH3OCH3-12e-+3H2O=2CO2+12H+,
故答案为:CH3OCH3-12e-+3H2O=2CO2+12H+.
点评 本题考查了运用盖斯定律计算焓变、热化学方程式的书写、影响化学平衡的因素、燃料电池等重要考点,涉及的知识点较多,综合性较强,难度较大.


| A. | 锌片发生氧化反应 | B. | 电子由锌片通过导线流向铜片 | ||
| C. | 铜片反应式为Cu2++2e-═Cu | D. | 该电池的反应本质是氧化还原反应 |
| A. | 形成离子键的阴、阳离子间只存在静电吸引力 | |
| B. | 核外电子排布相同的微粒,化学性质相同 | |
| C. | 所有物质中均存在化学键 | |
| D. | 离子化合物中一定含有离子键 |
正极反应:6O2+24H++24e-$\frac{\underline{\;催化剂\;}}{\;}$12H2O
负极反应:C6H12O6+6H2O-24e-$\frac{\underline{\;催化剂\;}}{\;}$6CO2↑+24H+
则有关该电池的下列说法正确的是( )
| A. | 该电池的工作环境是高温条件 | |
| B. | 作为负极的葡萄糖(C6H12O6)在变化中失去电子,被还原 | |
| C. | 该电池的电解质溶液是强酸性溶液,如浓硫酸或硝酸等 | |
| D. | 该电池的总反应为C6H12O6+6O2$\frac{\underline{\;催化剂\;}}{\;}$6CO2+6H2O |
| A. | 无色溶液中:K+、Na+、MnO4-、SO42- | |
| B. | 在酸性溶液中:Ba2+、Na+、SO42-、Cl- | |
| C. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ | |
| D. | 含大量Fe2+溶液中:K+、Cl-、NO3-、Na+ |
 某学习小组针对化学能转变为其他形式的能量,进行如下实验:
某学习小组针对化学能转变为其他形式的能量,进行如下实验:
