题目内容
12.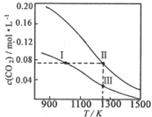 在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 状态Ⅱ和状态ⅢCO2的转化率相同 | |
| B. | 体系的总压强PⅢ:P总(状态Ⅱ)>2PⅠ (状态Ⅰ) | |
| C. | 反应的平衡常数:KⅠ>KⅡ=KⅢ | |
| D. | 逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ) |
分析 A.由图象可知,状态Ⅱ和状态Ⅲ平衡时CO2的浓度不同;
B.分别加入0.1molCO2和0.2molCO2,曲线I为加入0.1molCO2,曲线II为加入0.2molCO2,加压CO2(g)+C(s)?2CO(g)平衡逆向移动;
C.状态II、状态Ⅲ的温度相同,状态II看作先加入0.1molCO2,与状态Ⅲ平衡时CO的浓度相同,再加入0.1molCO2,若平衡不移动,Ⅱ状态CO的浓度等于2倍Ⅲ,但再充入CO2,相当增大压强,平衡左移动,消耗CO;
D.状态I、状态Ⅲ的温度不同,温度高反应速率快.
解答 解:A.由图象可知,状态Ⅱ和状态Ⅲ平衡时CO2的浓度不同,所以转化率不同,故A错误;
B.分别加入0.1molCO2和0.2molCO2,曲线I为加入0.1molCO2,曲线II为加入0.2molCO2,若平衡不移动,体系的总压强为P总(状态Ⅱ)=2P总(状态Ⅰ),但加压CO2(g)+C(s)?2CO(g)平衡逆向移动,为使c(CO2)相同,则加热使平衡正向移动,则体系的总压强为P总(状态Ⅱ)>2P总(状态Ⅰ),故B正确;
C.状态II、状态Ⅲ的温度相同,所以KⅡ=KⅢ,又由图中温度高平衡时c(CO2)小,则升高温度平衡正向移动,则温度高K大,所以KⅠ<KⅡ=KⅢ,故C错误;
D.状态I、状态Ⅲ的温度不同,温度高反应速率快,则逆反应速率为V逆(状态Ⅰ)<V逆(状态Ⅲ),故D错误;
故选B.
点评 本题考查化学平衡及平衡的建立,为高频考点,把握平衡移动的影响因素、图象分析为解答的关键,选项B为解答的难点,题目难度中等.

练习册系列答案
相关题目
6.已知,还原性Fe>Cu>Fe2+.将m g铁放入含有a mol FeCl3和b mol CuCl2的混合溶液中,充分反应后,固体粉末仍为m g.则a:b可能是( )
| A. | 8:7 | B. | 2:7 | C. | 1:1 | D. | 1:5 |
20.关于如图所示的原电池,下列说法不正确的是( )


| A. | 锌片发生氧化反应 | B. | 电子由锌片通过导线流向铜片 | ||
| C. | 铜片反应式为Cu2++2e-═Cu | D. | 该电池的反应本质是氧化还原反应 |
17.下列说法中正确的是( )
| A. | 形成离子键的阴、阳离子间只存在静电吸引力 | |
| B. | 核外电子排布相同的微粒,化学性质相同 | |
| C. | 所有物质中均存在化学键 | |
| D. | 离子化合物中一定含有离子键 |
4.微生物燃料电池因具有原料广泛、操作条件温和、清洁高效和资源利用率高、无污染等特点而被人们所重视.以用葡萄糖作底物的燃料电池为例,其正负极反应式如下:
正极反应:6O2+24H++24e-$\frac{\underline{\;催化剂\;}}{\;}$12H2O
负极反应:C6H12O6+6H2O-24e-$\frac{\underline{\;催化剂\;}}{\;}$6CO2↑+24H+
则有关该电池的下列说法正确的是( )
正极反应:6O2+24H++24e-$\frac{\underline{\;催化剂\;}}{\;}$12H2O
负极反应:C6H12O6+6H2O-24e-$\frac{\underline{\;催化剂\;}}{\;}$6CO2↑+24H+
则有关该电池的下列说法正确的是( )
| A. | 该电池的工作环境是高温条件 | |
| B. | 作为负极的葡萄糖(C6H12O6)在变化中失去电子,被还原 | |
| C. | 该电池的电解质溶液是强酸性溶液,如浓硫酸或硝酸等 | |
| D. | 该电池的总反应为C6H12O6+6O2$\frac{\underline{\;催化剂\;}}{\;}$6CO2+6H2O |
2.根据下表中的信息回答问题:
(1)B的原子结构示意图为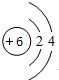 ,物质X的化学式为SiO2
,物质X的化学式为SiO2
(2)C、D、F三种元素对应的氢化物稳定性大小顺序是H2O>NH3>SiH4(填化学式)
(3)A、D、E三种元素形成的化合物中存在的化学键类型是离子键、共价键
(4)有两种盐,它们均由A、D、E、G四种元素组成,二者在溶液中反应的离子方程式是H++HSO3-=SO2↑+H2O
(5)B、F两元素中非金属性较强的是碳(写出元素名称),请设计一个简单的实验证明这一结论取硅酸钠溶液于试管中,向其中通入二氧化碳气体,观察是否有白色沉淀产生.
| Ⅰ | A、B、C、D、E、F、G七种短周期元素的原子序数依次增大 |
| Ⅱ | A和E同主族,B和F同主族,D和G同主族 |
| Ⅲ | A原子核内只有质子没有中子,B原子最外层电子数是电子层数的2倍 |
| Ⅳ | D和F以原子个数比为2:1组成的物质X是光导纤维的主要成分 |
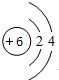 ,物质X的化学式为SiO2
,物质X的化学式为SiO2(2)C、D、F三种元素对应的氢化物稳定性大小顺序是H2O>NH3>SiH4(填化学式)
(3)A、D、E三种元素形成的化合物中存在的化学键类型是离子键、共价键
(4)有两种盐,它们均由A、D、E、G四种元素组成,二者在溶液中反应的离子方程式是H++HSO3-=SO2↑+H2O
(5)B、F两元素中非金属性较强的是碳(写出元素名称),请设计一个简单的实验证明这一结论取硅酸钠溶液于试管中,向其中通入二氧化碳气体,观察是否有白色沉淀产生.
 CH3COOC2H5+H2O
CH3COOC2H5+H2O