题目内容
9.下列各组元素按第一电离能增加顺序排列的是( )| A. | Na、Al、Mg | B. | Be、B、Li | C. | Li、Na、K | D. | O、F、N |
分析 同一主族元素的第一电离能随着原子序数的增大而减小,同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的.同一周期中稀有气体的第一电离能最大,据此分析.
解答 解:同一主族元素的第一电离能随着原子序数的增大而减小,同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的.
A.Na、Mg、Al属于同一周期元素且原子序数依次增大,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅡA元素的第一电离能大于第ⅢA族的,所以Na、Al、Mg的第一电离能依次增大,故A正确;
B.B、Be、Li属于同一周期元素且原子序数依次减小,其第一电离能随着原子序数的增大而增大,但第ⅡA元素的第一电离能大于第ⅢA族的,所以其第一电离能增加顺序为Li、B、Be,故B错误;
C.Li、Na、K属于同一主族元素且原子序数依次增大,其第一电离能随着原子序数的增大而减小,所以其第一电离能依次减小,故C错误;
D.F、O、N属于同一周期元素且原子序数依次减小,同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,故第一电离能顺序为:F>N>O,故D错误;
故选A.
点评 本题考查了第一电离能大小的判断,题目难度不大,根据元素周期律来分析解答即可,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的.

练习册系列答案
相关题目
20.下列试剂中可用于除去CO2中少量SO2杂质的有( )
①饱和NaHCO3溶液 ②酸性KMnO4溶液 ③溴水 ④饱和Na2CO3溶液.
①饱和NaHCO3溶液 ②酸性KMnO4溶液 ③溴水 ④饱和Na2CO3溶液.
| A. | ②③④ | B. | ①③④ | C. | ①②③ | D. | ①②④ |
20.下列说法正确的是( )
| A. | 石油经过分馏及裂化等方法得到的物质均为纯净物 | |
| B. | 乙酸乙酯、油脂、葡萄糖、蛋白质均可以发生水解反应 | |
| C. | 化合物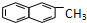 是苯的同系物 是苯的同系物 | |
| D. | 地沟油和矿物油可通过加足量的氢氧化钠溶液加热后的不同现象加以区别 |
17.下列说法正确的是( )
| A. | 共价化合物中不含离子键 | |
| B. | 凡是金属元素跟非金属元素化合形成离子化合物 | |
| C. | 离子化合物中的阳离子都是金属离子 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
4.某同学做同周期元素性质递变规律实验时,设计了一套实验方案,并记录了有关实验现象(见下表,表中左右的“实验方案”与“实验现象”不一定是对应关系).
请你帮助该同学整理并完成实验报告.
(1)实验目的:研究第3周期元素性质的递变规律.
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH
溶液,酚酞溶液等.
仪器:砂纸,试管,试管夹,①酒精灯,火柴,胶头滴管,烧杯,镊子,小刀,玻璃片,②滤纸等.
(3)实验内容:
①的化学方程式Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑,
②的离子方程式S2-+Cl2=2Cl-+S↓.
(4)实验结论:第3周期,随着原子序数的递增,元素的金属性减弱,非金属性增强;.
| 实验方案 | 实验现象 |
| ①镁条除去氧化膜后,放入试管中,加入少量水,加热至沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变红色 |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将除去氧化膜的镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
| ⑤将除去氧化膜的铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
(1)实验目的:研究第3周期元素性质的递变规律.
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH
溶液,酚酞溶液等.
仪器:砂纸,试管,试管夹,①酒精灯,火柴,胶头滴管,烧杯,镊子,小刀,玻璃片,②滤纸等.
(3)实验内容:
| 实验方案 | ② | ④ | ⑥ |
| 实验现象(填A~F) |
②的离子方程式S2-+Cl2=2Cl-+S↓.
(4)实验结论:第3周期,随着原子序数的递增,元素的金属性减弱,非金属性增强;.
19.在mA+nB=pC的反应中,(m、n、p为各物质的化学计量数)现测得C每2分钟增加 4mol.L-1,B每分钟减少1.5mol.L-1,A每分钟减少0.5mol.L-1,则m:n:p为( )
| A. | 2:3:2 | B. | 2:2:3 | C. | 1:3:4 | D. | 3:1:2 |
