题目内容
3.化学反应A2+B2═2AB的能量变化如图所示,则下列说法不正确的是( )
| A. | 该反应是放热反应 | |
| B. | 断裂2 mol A-B 键需要吸收y kJ的能量 | |
| C. | 断裂1 mol A-A 键和1 mol B-B 键放出x kJ能量 | |
| D. | 1 mol A2和1 mol B2的总能量高于2 mol AB的总能量 |
分析 A、由图象分析,反应物的能量高于生成物的能量时,反应是放热反应;
B、旧键的断裂吸收能量,新键的生成释放能量;
C、旧键的断裂吸收能量;
D、根据图象可判断反应物与生成物的总能量大小关系.
解答 解:A、因反应物的能量高于生成物的能量时,所以反应是放热反应,故A错误;
B、旧键的断裂吸收能量,由图可知断裂2molA-B键需要吸收ykJ能量,故B错误;
C、旧键的断裂吸收能量,而不是释放能量,故C错误;
D、由图可知,1molA2和1molB2的总能量高于2molAB的总能量,故D正确;
故选D.
点评 本题考查学生有关化学反应中的能量变化知识,可以根据所学知识来进行,难度不大.

练习册系列答案
相关题目
11.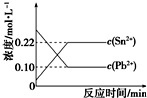 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )| A. | 25℃时,该反应的平衡常数K=2.2 | |
| B. | 往平衡体系中加入金属铅后,c(Pb2+)增大 | |
| C. | 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 | |
| D. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
12.NA代表阿伏加德罗常数,下列叙述正确的是( )
| A. | 1 mo1 Na2O2与足量H2O反应,转移了2 NA 个电子 | |
| B. | 1 mol O2在反应中得到电子数一定为4 NA | |
| C. | 1 mol Cl2在反应中得到电子数不一定为2NA | |
| D. | 在2KClO3+4HC1(浓)═2KCl+2C1O2↑+C12↑+2H2O中,氯气既是氧化产物又是还原产物,每生成1 mol Cl2转移2 NA 个电子 |
13.水是一种廉价而且非常有用的试剂,下列用水就能鉴别的一组物质是( )
| A. | 苯、乙醇、四氯化碳 | B. | 苯、溴苯、四氯化碳 | ||
| C. | 硝基苯、乙醇、四氯化碳 | D. | 硝基苯、乙醇、乙酸 |

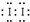 (用电子式表示).
(用电子式表示).