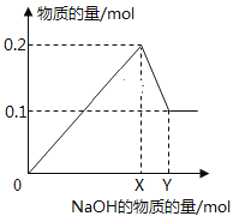
题目内容
【题目】已知四种元素A、B、C、D,其原子序数依次增大,最外层电子数依次为4、1、2、7,其中A元素原子次外层电子数为2,B、C 两元素的原子次外层电子数为8,B元素原子最外层电子数比第1层电子数少1,也比C元素原子第M层电子数少1,D元素的单质为液态非金属单质。若此四种元素均位于元素周期表前四个周期,请按要求填写下列各题:
(1)A原子的原子结构示意图为_____,D元素在元素周期表中的位置为______。
(2)B元素的最高价氧化物对应的水化物用电子式表示为______________,C、D两元素形成的化合物化学键类型为__________。
(3)请写出D元素的单质与SO2同时通入水中反应的化学方程式:___________。
【答案】 ![]() 第四周期第ⅦA族
第四周期第ⅦA族 ![]() 离子键 Br2+SO2+2H2O=2HBr+H2SO4
离子键 Br2+SO2+2H2O=2HBr+H2SO4
【解析】试题分析:A元素原子次外层电子数为2,最外层电子数是4,所以A为C元素;B、C 两元素的原子次外层电子数为8,B元素原子最外层电子数比第1层电子数少1,则B为三层电子,为Na元素;也比C元素原子第M层电子数少1,C的最外层电子数是2,B的最外层电子数是1,则C的M层电子数是2,即M是最外层,所以C是Mg元素;D元素的单质为液态非金属单质,则D是Br元素。
(1)C元素的原子结构示意图为![]() ,Br元素在元素周期表中位于第四周期第VIIA族;
,Br元素在元素周期表中位于第四周期第VIIA族;
(2)Na元素的最关键氧化物的水化物hi氢氧化钠,为离子化合物,所以其电子式是![]() ;Br为活泼非金属,而Mg属于活泼金属,二者易形成离子化合物,化学键类型为离子键;
;Br为活泼非金属,而Mg属于活泼金属,二者易形成离子化合物,化学键类型为离子键;
(3)溴单质与二氧化硫同时通入水中,则发生氧化还原反应,生成两种强酸,化学方程式是Br2+SO2+2H2O=2HBr+H2SO4。

 阅读快车系列答案
阅读快车系列答案【题目】X、Y、Z、M、W、Q、R是7种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | W | Q | R |
原子半径/nm | 0.186 | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | 0.032 |
主要化合价 | +1 | +3 | +6,﹣2 | +7,﹣1 | +5,﹣3 | ﹣2 | +1 |
完成下列填空:
(1)上述元素中,金属性最强的在周期表中的位置是________________________________;X、Y、Q各自形成的简单离子中,离子半径由大到小的顺序是_______(填离子符号)。
W和R按原子个数比1﹕4构成的阳离子所含的化学键是____________________。
(2)表中所列4种第三周期元素的最高价氧化物的水化物碱性最弱的是_______(填化学
式),其电离方程式为_____________________________________。
(3)M与Z相比,非金属性较强的是_____________(填元素名称),请从原子结构的角度说明理由_________________________________________________________________。
(4)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应,反应方程式如下:
![]() KMnO4+
KMnO4+![]() H2O2+
H2O2+![]() H2SO4 →
H2SO4 → ![]() K2SO4+
K2SO4+![]() MnSO4+
MnSO4+![]() O2↑+
O2↑+![]() H2O
H2O
请配平,当有0.5 mol H2O2参加此反应,电子转移的个数为______________________。
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是

A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0