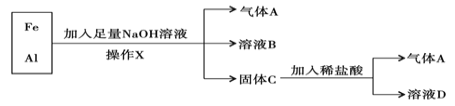
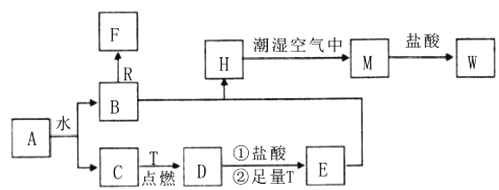
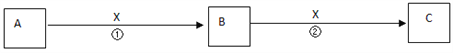
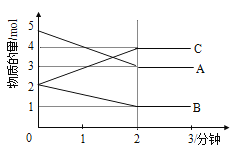
��Ŀ����
����Ŀ��X��Y��Z��M��W��Q��R��7�ֶ�����Ԫ�أ���ԭ�Ӱ뾶����Ҫ���ϼ����£�
Ԫ�ش��� | X | Y | Z | M | W | Q | R |
ԭ�Ӱ뾶/nm | 0.186 | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | 0.032 |
��Ҫ���ϼ� | +1 | +3 | +6����2 | +7����1 | +5����3 | ��2 | +1 |
���������գ�
��1������Ԫ���У���������ǿ�������ڱ��е�λ����________________________________��X��Y��Q�����γɵļ������������Ӱ뾶�ɴ�С��˳����_______(�����ӷ���)��
W��R��ԭ�Ӹ�����1�s4���ɵ������������Ļ�ѧ����____________________��
��2����������4�ֵ�������Ԫ�ص�����������ˮ���������������_______(�ѧ
ʽ)������뷽��ʽΪ_____________________________________��
��3��M��Z��ȣ��ǽ����Խ�ǿ����_____________����Ԫ�����ƣ������ԭ�ӽṹ�ĽǶ�˵������_________________________________________________________________��
��4����ϡ�����У�KMnO4��H2O2�ܷ���������ԭ��Ӧ����Ӧ����ʽ���£�
![]() KMnO4��
KMnO4��![]() H2O2+
H2O2+![]() H2SO4 ��
H2SO4 �� ![]() K2SO4��
K2SO4��![]() MnSO4��
MnSO4��![]() O2����
O2����![]() H2O
H2O
����ƽ������0.5 mol H2O2�μӴ˷�Ӧ������ת�Ƶĸ���Ϊ______________________��
���𰸡� �������ڢ�A�� O2����Na+��Al3+�� ���ۼ� Al (OH)3 H+ + Al O2��+H2O ![]() Al (OH)3
Al (OH)3![]() Al 3++3OH�� �� ��ԭ������ԭ�ӵ��Ӳ�����ͬ����ԭ���������7�����ӣ���ԭ���������6�����ӣ� �ȵ�ԭ�Ӱ뾶�����ԭ�Ӱ뾶С��ԭ�Ӻ˶������ӵ�����������������ȵķǽ����Ը�ǿ 2KMnO4��5 H2O2+3H2SO4 �� 1 K2SO4��2 MnSO4��5 O2����8 H2O��6.02��1023
Al 3++3OH�� �� ��ԭ������ԭ�ӵ��Ӳ�����ͬ����ԭ���������7�����ӣ���ԭ���������6�����ӣ� �ȵ�ԭ�Ӱ뾶�����ԭ�Ӱ뾶С��ԭ�Ӻ˶������ӵ�����������������ȵķǽ����Ը�ǿ 2KMnO4��5 H2O2+3H2SO4 �� 1 K2SO4��2 MnSO4��5 O2����8 H2O��6.02��1023
��������X��R�Ļ��ϼ۶�Ϊ+1�ۣ�ӦΪ���ڱ��ڢ�A�壬���ݰ뾶��ϵ��֪RΪH��XΪNa��Z��Q�Ļ��ϼ۶���-2�ۣ�ӦΪ���ڱ��ڢ�A��Ԫ�أ�Z�����Ϊ+6�ۣ�ӦΪSԪ�أ�Q�����ۣ�ӦΪOԪ�أ�Y�Ļ��ϼ�Ϊ+3�ۣ�ӦΪ���ڱ��ڢ�A��Ԫ�أ����ݰ뾶����ZС��X��֪Ӧ��Xͬ���ڣ�ΪAlԪ�أ�MΪ+7��-1�ۣ���ԭ�Ӱ뾶С��S����O����MΪClԪ�أ�WΪ+5��-3�ۣ���ԭ�Ӱ뾶С��Cl����O����MΪNԪ�ء���1������Ԫ���У���������ǿ��ΪNa�������ڱ��е�λ���ǵ������ڢ�A�壻X��Y��Q�����γɵļ�����Na+��Al3+��O2-������ͬ���Ӳ�ṹ���˵����Խ��뾶ԽС�������Ӱ뾶�ɴ�С��˳����O2����Na+��Al3+��W��R��ԭ�Ӹ�����1�s4���ɵ�������NH���������Ļ�ѧ���ǹ��ۼ�����2����������4�ֵ�������Ԫ��Na��Al��S��Cl������������ˮ���������������Al (OH)3������뷽��ʽΪH+ + Al O2��+H2O ![]() Al (OH)3
Al (OH)3![]() Al 3++3OH������3��ͬ����Ԫ�ش����ҷǽ��������μ�������Cl��S��ȣ��ǽ����Խ�ǿ������Ԫ�أ���ԭ�ӽṹ�ĽǶ�˵������Ϊ��ԭ������ԭ�ӵ��Ӳ�����ͬ����ԭ���������7�����ӣ���ԭ���������6�����ӣ� �ȵ�ԭ�Ӱ뾶�����ԭ�Ӱ뾶С��ԭ�Ӻ˶������ӵ�����������������ȵķǽ����Ը�ǿ����4����Ӧ��KMnO4���̻��ϼ���+7�۱�Ϊ+2�ۣ�H2O2����Ԫ����-1�۱�Ϊ0�ۣ�ת�Ƶ�����Ϊ5
Al 3++3OH������3��ͬ����Ԫ�ش����ҷǽ��������μ�������Cl��S��ȣ��ǽ����Խ�ǿ������Ԫ�أ���ԭ�ӽṹ�ĽǶ�˵������Ϊ��ԭ������ԭ�ӵ��Ӳ�����ͬ����ԭ���������7�����ӣ���ԭ���������6�����ӣ� �ȵ�ԭ�Ӱ뾶�����ԭ�Ӱ뾶С��ԭ�Ӻ˶������ӵ�����������������ȵķǽ����Ը�ǿ����4����Ӧ��KMnO4���̻��ϼ���+7�۱�Ϊ+2�ۣ�H2O2����Ԫ����-1�۱�Ϊ0�ۣ�ת�Ƶ�����Ϊ5![]() �����������ԭ��Ӧ�������غ���ƽ����Ӧ����ʽ���£�2KMnO4��5 H2O2+3H2SO4 =1 K2SO4��2 MnSO4��5 O2����8 H2O������0.5 mol H2O2�μӴ˷�Ӧ������ת�Ƶĸ���Ϊ0.5 mol
�����������ԭ��Ӧ�������غ���ƽ����Ӧ����ʽ���£�2KMnO4��5 H2O2+3H2SO4 =1 K2SO4��2 MnSO4��5 O2����8 H2O������0.5 mol H2O2�μӴ˷�Ӧ������ת�Ƶĸ���Ϊ0.5 mol![]() =
=![]() =6.02��1023��
=6.02��1023��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�