题目内容
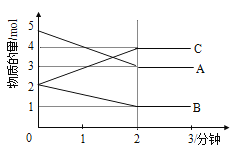
【题目】在一定质量的AlCl3和MgCl2混合溶液中逐渐滴入一定溶质质量分数的NaOH溶液,生成沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则:
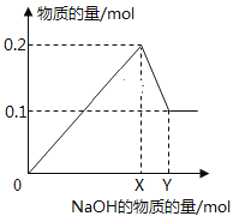
(1)O-X段反应的离子方程式为:________________________,
(2)X-Y段反应的离子方程式为_________________________
(3)生成Mg(OH)2的质量为___________________g;
(4)X=________________;Y=______________。
【答案】Al3++3OH-=Al(OH)3↓ Mg2++2OH-=Mg(OH)2↓ Al(OH)3+OH-=AlO2-+2H2O 5.8 0.5 0.6
【解析】
根据图示信息可知,OX段为AlCl3和MgCl2分别于NaOH反应生成Mg(OH)2和Al(OH)3的过程,沉淀总的物质的量为0.2 mol,XY段为Al(OH)3溶解于NaOH的过程,故n[Al(OH)3] = 0.2 mol- 0.1 mol= 0.1 mol,当沉淀不再随氢氧化钠溶液质量的增加而变化时即为Mg(OH)2的物质的量,则n[Mg(OH)2] = 0.1 mol,根据n = ![]() 得出Mg(OH)2的质量,图中X值为与一定质量的AlCl3和MgCl2混合溶液反应的氢氧化钠的总的物质的量,而Y值为恰好完全反应时所滴加的氢氧化钠的物质的量,此时氢氧化钠的物质的量为与一定质量的AlCl3和MgCl2混合溶液反应的氢氧化钠的物质的量及与氢氧化铝沉淀反应的氢氧化钠的物质的量之和,据此分析作答。
得出Mg(OH)2的质量,图中X值为与一定质量的AlCl3和MgCl2混合溶液反应的氢氧化钠的总的物质的量,而Y值为恰好完全反应时所滴加的氢氧化钠的物质的量,此时氢氧化钠的物质的量为与一定质量的AlCl3和MgCl2混合溶液反应的氢氧化钠的物质的量及与氢氧化铝沉淀反应的氢氧化钠的物质的量之和,据此分析作答。
(1)结合上述分析,根据关系图可知,NaOH溶液与一定质量的AlCl3和MgCl2混合溶液后起初O-X段会生成氢氧化镁、氢氧化铝沉淀,其离子方程式为:Al3++3OH-=Al(OH)3↓ Mg2++2OH-=Mg(OH)2↓,
故答案为:Al3++3OH-=Al(OH)3↓ Mg2++2OH-=Mg(OH)2↓;
(2)X-Y段则为氢氧化钠溶解Al(OH)3的过程,其离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)由上述分析可知,n[Mg(OH)2] = 0.1 mol,则生成Mg(OH)2的质量为0.1 mol![]() 58 g/mol = 5.8 g,
58 g/mol = 5.8 g,
故答案为:5.8;
(4)根据关系式及原子守恒可知,n(Mg) = n[Mg(OH)2] = 0.1 mol,则镁离子消耗的氢氧化钠的物质的量为2![]() 0.1 mol = 0.2 mol,同理,n(Al) = n[Al(OH)3] = 0.2 mol- 0.1 mol= 0.1 mol,则铝离子消耗的氢氧化钠的物质的量为 3
0.1 mol = 0.2 mol,同理,n(Al) = n[Al(OH)3] = 0.2 mol- 0.1 mol= 0.1 mol,则铝离子消耗的氢氧化钠的物质的量为 3![]() 0.1 mol = 0.3 mol,故X= 0.5,再根据氢氧化钠 与氢氧化铝按物质的量之比为1:1反应可知,溶解Al(OH)3消耗的氢氧化钠的物质的量为 0.1 mol,即Y = X+0.1 mol = 0.5+0.1 = 0.6mol,
0.1 mol = 0.3 mol,故X= 0.5,再根据氢氧化钠 与氢氧化铝按物质的量之比为1:1反应可知,溶解Al(OH)3消耗的氢氧化钠的物质的量为 0.1 mol,即Y = X+0.1 mol = 0.5+0.1 = 0.6mol,
故答案为:0.5;0.6。