��Ŀ����
����Ŀ��ijͬѧ������ͼװ�ý���ʵ�飬֤����ͭ��ϡ���ᷴӦ������NO��ʵ��ʱ������ע�����ڼ���һ������ϡ���ᣬ�ž�ע�����ڵĿ�����Ѹ�ٽ�����ͭ˿����Ƥñ���ϣ�һ��ʱ���ע����������ɫ���������
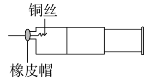
��1��ͭ��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ__��
��2��NO�Ǵ�����Ⱦ��֮һ��Ŀǰ��һ��������������400�����ҡ��д������ڵ�����£��ð�����NO��ԭΪ������ˮ���÷�Ӧ�Ļ�ѧ����ʽΪ4NH3+6NO![]() 5N2+6H2O��ÿ��10molN2���ɣ����������뻹ԭ��������ʵ���֮��Ϊ__��
5N2+6H2O��ÿ��10molN2���ɣ����������뻹ԭ��������ʵ���֮��Ϊ__��
��3��N2O4Ϊ����������������ȼ��ƫ�����£�C2H8N2����Ӧ���ų����������ѻ������̫�գ�ͬʱ�������������壬��Ӧ�Ļ�ѧ����ʽΪ__��
��4����д��ʵ������NH4Cl��Ca(OH)2������ȡ�����Ļ�ѧ����ʽ__��
�ڽ�����Ȫʵ�飬����ˮ�м����̪���õ���ɫ��Ȫ����ʵ�������˰�����������Ҫ���ʷֱ���__��__��
���𰸡�3Cu+8HNO3(ϡ)=3Cu(NO3)2+2NO��+4H2O 2��3 C2H8N2+2N2O4=2CO2��+3N2��+4H2O�� 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O ����������ˮ ������ˮ��Ӧ���ɼ�
CaCl2+2NH3��+2H2O ����������ˮ ������ˮ��Ӧ���ɼ�
��������
��1��ͭ��ϡ���ᷴӦ����NO���塢����ͭ��ˮ�����ԭ���غ���ƽ��д��ѧ����ʽ��
��2����Ӧ4NH3+6NO�T5N2+6H2O�У�NOΪ��������NH3Ϊ��ԭ����ÿ����5molN2����6molNO����ԭ��4molNH3������������ת������Ϊ12mol��
��3��N2O4Ϊ��������ƫ�����£�C2H8N2��Ϊ��ԭ�����ڷ�Ӧ�е�Ԫ�ػ��ϼ۽��ͣ��õ�������ֻ��Ϊ������̼Ԫ�ؼ�̬���ߣ��õ�������ֻ��Ϊ������̼��
��4����ˮ������Ȫ�����뼫������ˮ����̪�����졣
��1��ͭ��ϡ���ᷴӦ����NO���壬��Ӧ�Ļ�ѧ����ʽΪ3Cu+8HNO3=3Cu��NO3��2+2NO��+4H2O��
��2����Ӧ4NH3+6NO�T5N2+6H2O�У�NOΪ��������NH3Ϊ��ԭ����ÿ����5molN2����6molNO����ԭ��4molNH3������������ת������Ϊ12mol����ÿ��10molN2���ɣ�����ת�����ʵ���Ϊ24mol����������ͻ�ԭ�������ʵ���֮��=4��6=2��3��
��3��N2O4��ƫ�����£�C2H8N2����Ӧ�õ������������壬���Զ��߷�Ӧ����������ǵ�����������̼�����������ˮ����Ӧ�Ļ�ѧ����ʽΪC2H8N2+2N2O4=2CO2��+3N2��+4H2O����
��4��ʵ�����Ʊ������ķ���ʽΪ2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O��������ˮ��������Ȫ����˵��������������ˮ���õ���ɫ��Ȫ��˵��ˮ��Һ�Լ��ԣ�������ˮ��Ӧ������һˮ�ϰ���һˮ�ϰ������
CaCl2+2NH3��+2H2O��������ˮ��������Ȫ����˵��������������ˮ���õ���ɫ��Ȫ��˵��ˮ��Һ�Լ��ԣ�������ˮ��Ӧ������һˮ�ϰ���һˮ�ϰ������

 ����ʦ��Сһ����ʦ������ҵϵ�д�
����ʦ��Сһ����ʦ������ҵϵ�д� ���100�ֵ�Ԫ�Ż�������ϵ�д�
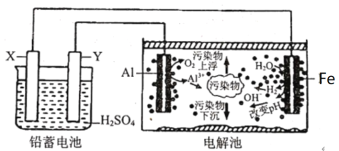
���100�ֵ�Ԫ�Ż�������ϵ�д�����Ŀ��ij��ѧ��ȤС����������ʾװ����ȡ����ء��������ƺ���ˮ������̽��ʵ�顣
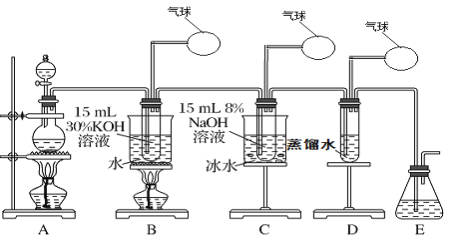
ʵ����.��ȡ����أ�KClO3�����������ơ���ˮ
��1��д��װ��Aʵ������ȡCl2�Ļ�ѧ��Ӧ����ʽ_________________________
��2����ȡʵ�������ȡ��װ��B�е��Թܣ���ȴ�ᾧ�����ˡ�ϴ�ӣ���ʵ�����������Ҫ�IJ��������н�ͷ�ιܡ��ձ���________��________��
��3��д��B���Ʊ�����أ�KClO3���ķ���ʽ____________________
��4��װ��C�з�Ӧ��Ҫ�ڱ�ˮԡ�н��У���ԭ����_____________________________
���ϣ�SO2��һ�������������CO2���ƣ�2NaOH(����)+SO2=Na2SO3+H2O ,SO32-�ǻ�ԭ�Ժ�ǿ�����ӣ�����Һ����������ǿ�����Ӳ��ܴ������棬�ױ�������SO42����
ʵ����.β������
ʵ��С�����ø����չ�����SO2��NaOH��Һ����β���������մ�����
��5������β��һ��ʱ�������Һ(ǿ����)�п϶�����Cl����OH����![]()
�����ʵ�飬̽��������Һ�п��ܴ��ڵ�����������(�����ǿ����е�CO2��Ӱ��)��
������������裺
����1��ֻ����![]() ��
��
����2���Ȳ�����![]() Ҳ������ClO����
Ҳ������ClO����
����3��______________________________��
�����ʵ�鷽��������ʵ�顣���ڱ���д��ʵ�鲽���Լ�Ԥ������ͽ��ۡ�
��ѡʵ���Լ���3mol��L��1 H2SO4��1mol��L��1 NaOH��Һ��0.01mol��L��1����KMnO4��Һ�����ۡ�KI��Һ��
ʵ�鲽�� | Ԥ������ͽ��� |
����1��ȡ��������Һ������A��B�Թ��� | |
����2����A�Թ��еμ�0.01 mol��L��1����KMnO4��Һ | (1)����Һ��ɫ�������1���� (2)����Һ����ɫ�������2��3���� |
����3��____________________________________ | __________________________________ |
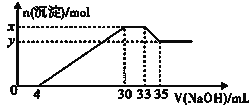
����Ŀ��ijʵ��С����100mL0.50mol/LNaOH��Һ��60mL0.50mol/L��������к��ȵIJⶨ��װ����ͼ��ʾ���ش��������⣺
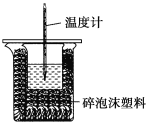
��1����ʵ�鹲��Ҫ400mLNaOH��Һ��ʵ���������Ƹ���Һʱ������Ҫ����NaOH����____g��
��2��ͼ��װ��ȱ�ٵ�������____��
��3�������Թ�����ԭ����____��
��4������д�±��е�ƽ���¶Ȳ
ʵ�� ���� | ��ʼ�¶�T1/�� | ��ֹ�¶� T2/�� | ƽ���¶Ȳ� (T2��T1)/�� | ||
HCl | NaOH | ƽ��ֵ | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ____ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
��5��������Ϊ0.50 mol/L NaOH��Һ��0.50 mol/L������Һ���ܶȶ���1 g/cm3���кͺ�������Һ�ı�����Ϊc=4.18J/(g��)������ʵ���к�����H=___��ȡС�����һλ��
��6������ʵ������57.3kJ/mol��ƫ�����ƫ���ԭ�������____
A����ȡNaOH��Һʱ���Ӷ���
B��Ϊ��ʹ��Ӧ��֣����������зִμ����
C��ʵ��װ�ñ��¸���Ч����
D����ͭ˿���沣��������