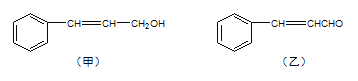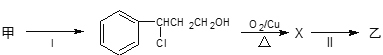题目内容
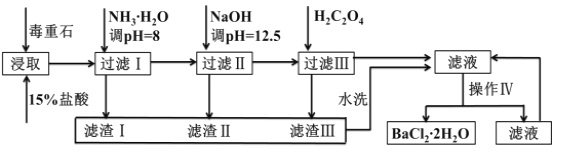
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
Ca2+ | Mg2+ | Fe3+ | ||
开始沉淀的pH | 11.9 | 9.1 | 1.9 | |
完全沉淀的pH | 13.9 | 11.1 | 3.2 | |
已知:室温条件下BaC2O4和CaC2O4均为沉淀,但BaC2O4的溶解度相对较大
(1)实验室用37%的盐酸配制1mol/L盐酸,下列仪器中,不需要使用的是_____
a.容量瓶 b.量筒 c.烧杯d.滴定管
(2)为了加快毒重石的酸浸速率,可以采取的措施有________________________(至少两条)。
(3)加入氨水调节溶液pH=8的目的是__________________。滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________________________________。
(4)操作Ⅳ的步骤是:___________、___________、过滤。
【答案】 d 研磨成粉、加热、搅拌 使Fe3+形成Fe(OH)3沉淀而除去 Mg(OH)2、Ca(OH)2 H2C2O4过量会导致形成BaC2O4沉淀产品产量减少 蒸发浓缩 冷却结晶;
【解析】
制备BaCl22H2O的流程:毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),加盐酸溶解,碳酸钡和盐酸反应:BaCO3+2H+=Ba2++CO2↑+H2O,加入氨水,调pH为8,Fe3+完全沉淀时的pH为3.2,只有Fe3+完全沉淀,滤渣I为Fe(OH)3,溶液中主要含Ca2+、Mg2+、Ba2+,加入氢氧化钠调节pH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;溶液中主要含Ca2+、Ba2+,加入H2C2O4,得到CaC2O4沉淀,除去Ca2+,BaCl2溶液蒸发浓缩、冷却结晶得到BaCl22H2O;
(1)实验室用37%的盐酸配制1mol/L的盐酸,需计算出浓盐酸的体积,需用量筒量取,浓盐酸稀释为稀盐酸,需用烧杯作为容器稀释,玻璃棒搅拌加速溶解,定容时需要使用容量瓶,则不需要滴定管,故答案为d;
(2)采取将毒重石研磨成粉、加热、搅拌等措施,均可提高毒重石的酸浸速率;
(3)根据流程图和表中数据可知:Fe3+完全沉淀时的pH为3.2,加入氨水,调pH为8,Fe3++3NH3H2O=Fe(OH)3↓+3NH4+,Fe3+完全沉淀,滤渣I为Fe(OH)3,加入氢氧化钠调节pH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2,溶液中主要含Ca2+、Ba2+,室温条件下BaC2O4和CaC2O4均为沉淀,但BaC2O4的溶解度相对较大,加入H2C2O4先形成CaC2O4沉淀,加入H2C2O4时应避免过量,防止CaC2O4沉淀完全后,过量的H2C2O4会导致生成BaC2O4沉淀,产品的产量减少;
(4)操作Ⅳ的目的是从溶液中获得BaCl22H2O,可采取的操作是蒸发浓缩、冷却结晶、过滤。

 名校课堂系列答案
名校课堂系列答案