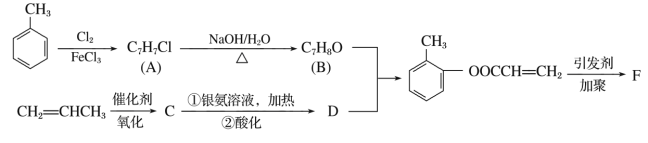
题目内容
【题目】如图是实验室制取SO2,并验证SO2的某些性质的装置(夹持装置和加热装置已略,气密性已检验)。请回答下列问题:
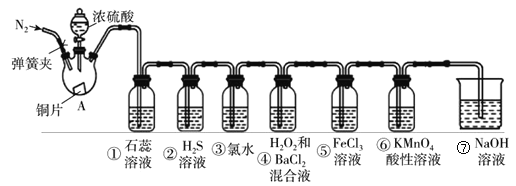
(1)在A中发生反应的化学方程式为:__________。
(2)③中化学反应方程式____,④中产生白色沉淀,离子方程式为________,⑤中的现象见溶液由黄色变为浅绿色,其反应的离子方程式为_________。
(3)能体现出SO2还原性的实验序号是____。
(4)实验结束后需要通入N2,其目的____。
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O SO2+Cl2+2H2O=H2SO4+2HCl H2O2+SO2+Ba2+=BaSO4↓+2H+ 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ ③④⑤⑥ 把装置内的SO2全部赶入⑦被NaOH溶液吸收,防止SO2污染环境
CuSO4+SO2↑+2H2O SO2+Cl2+2H2O=H2SO4+2HCl H2O2+SO2+Ba2+=BaSO4↓+2H+ 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ ③④⑤⑥ 把装置内的SO2全部赶入⑦被NaOH溶液吸收,防止SO2污染环境
【解析】
实验室制SO2并验证SO2某些性质,A中硫酸与Cu混合加热反应生成二氧化硫,①中二氧化硫与水反应生成亚硫酸,遇石蕊变红;②中SO2与H2S在溶液发生氧化还原反应,SO2被还原,H2S被氧化生成单质S;③中氯水与SO2发生氧化还原反应产生HCl和H2SO4,氯水褪色;④中SO与H2O2发生氧化还原反应产生H2SO4,H2SO4与BaCl2反应产生BaSO4白色沉淀;⑤中二氧化硫与FeCl3溶液发生氧化还原反应产生FeCl2、HCl和H2SO4,溶液黄色褪去;⑥中二氧化硫被高锰酸钾氧化变为H2SO4,KMnO4被还原为无色MnSO4而使高锰酸钾溶液褪色;⑦为尾气处理装置,二氧化硫与NaOH反应可防止二氧化硫排放在环境中,据此分析解答。
(1)在A中Cu与浓硫酸混合加热发生氧化还原反应,产生SO2,发生反应的化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)③中Cl2、SO2、H2O反应产生HCl和H2SO4,该反应的化学方程式为:SO2+Cl2+2H2O=H2SO4+2HCl;④中SO2先与H2O2发生氧化还原反应产生H2SO4,然后是反应产物H2SO4与BaCl2反应产生BaSO4白色沉淀,总反应的离子方程式为H2O2+SO2+Ba2+=BaSO4↓+2H+;⑤中SO2与FeCl3溶液发生氧化还原反应产生FeCl2、HCl和H2SO4,使溶液由黄色变为浅绿色,其反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(3)若反应中SO2中S元素化合价升高,失去电子,则表现还原性,在上述反应中能体现出SO2还原性的实验序号是③④⑤⑥;
(4)SO2是大气污染物,在实验结束时若滞留在反应装置中会导致大气污染,因此反应结束时向装置内通入N2,就可以把装置的SO2全部赶入⑦中被NaOH溶液吸收,防止SO2污染环境。

【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
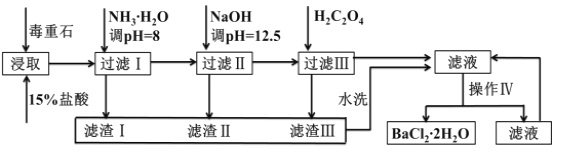
Ca2+ | Mg2+ | Fe3+ | ||
开始沉淀的pH | 11.9 | 9.1 | 1.9 | |
完全沉淀的pH | 13.9 | 11.1 | 3.2 | |
已知:室温条件下BaC2O4和CaC2O4均为沉淀,但BaC2O4的溶解度相对较大
(1)实验室用37%的盐酸配制1mol/L盐酸,下列仪器中,不需要使用的是_____
a.容量瓶 b.量筒 c.烧杯d.滴定管
(2)为了加快毒重石的酸浸速率,可以采取的措施有________________________(至少两条)。
(3)加入氨水调节溶液pH=8的目的是__________________。滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________________________________。
(4)操作Ⅳ的步骤是:___________、___________、过滤。