题目内容
【题目】已知反应A(g) + 3B(g)![]() 2C(g) + D(g),若在某时间段内以A的浓度变化表示的化学反应速率为1mol·L-1·min-1,则在此时间段内以C的浓度变化表示的化学反应速率为
2C(g) + D(g),若在某时间段内以A的浓度变化表示的化学反应速率为1mol·L-1·min-1,则在此时间段内以C的浓度变化表示的化学反应速率为
A. 0.5 mol·L-1·min-1B. 2 mol·L-1·min-1
C. 3 mol·L-1·min-1D. 1 mol·L-1·min-1
【答案】B
【解析】
根据不同物质表示的反应速率之比等于其化学计量数之比来计算v(C)。
对于反应A(g)+3B(g)![]() 2C(g)+D(g),以A的浓度变化表示的反应速率为1 mol·L-1·min-1,速率之比等于化学计量数之比,所以根据方程式可知v(C)=2×1 mol·L-1·min-1=2 mol·L-1·min-1,答案选B。
2C(g)+D(g),以A的浓度变化表示的反应速率为1 mol·L-1·min-1,速率之比等于化学计量数之比,所以根据方程式可知v(C)=2×1 mol·L-1·min-1=2 mol·L-1·min-1,答案选B。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案【题目】前四周期元素A、B、C、D、E、F原子序数依次增大,其相关性质如下表所示:
A | 2p能级电子半充满 |
B | 与A同周期,且原子核外有2个未成对电子 |
C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
D | 其基态原子外围电子排布为msnmpn+2 |
E | 前四周期元素中,E元素基态原子未成对电子数最多 |
F | 基态F+各能级电子全充满 |
请根据以上情况,回答下列问题:
(1)E元素基态原子核外有_______种能量不同的电子,电子排布式为________________,写出F元素基态原子的价电子排布图________________。
(2)B和C可形成一种同时含有共价键和离子键的化合物,其电子式为________。
(3)A、B、C、D四种元素:(用元素符号表示,下同)
①原子半径由小到大的顺序是___________________;
②第一电离能由大到小的顺序为__________________;
③电负性由大到小的顺序是____________________。
(4)判断下列分子或离子中空间构型是V形的是________(填写序号)。
a.SO2 b.H2O c.NO![]() d.NO
d.NO![]()
【题目】以Al和不同的铜盐溶液间的反应为实验对象,探索Al与不同铜盐溶液反应的多样性。
实验 | 向试管中加入2ml溶液 | 实验现象 |
| 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 60s:反应进一步加快且反应剧烈放热,液体几乎沸腾 120s:铝片反应完,试管中析出大量蓬松的红色物质 |
实验Ⅱ:0.5mol/LCuSO4溶液 | 15s无明显现象 60s:铝片表面有极少气泡 120s:有少量气泡溢出,铝片边缘有很少红色物质生成 |
(1)对实验Ⅰ进行研究
①实验Ⅰ中生成红色物质的离子方程式为: __________________________________________
②请写出60s后反应进一步加快可能的原因(写出一条)________________________________________________________________
(2)对实验Ⅱ进行研究
①实验Ⅱ反应明显比实验Ⅰ缓慢,说明Al与不同的铜盐溶液反应呈现多样性,其原因可能有:
②假设一:SO42-对Al与Cu2+的置换反应存在一定的抑制作用。
③假设二:________________________________________________
(3)为进一步研究上述假设,设计如下实验:
实验 | 向试管中加入2mL溶液 | 实验现象 |
| 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 | |
实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 | |
实验Ⅵ:0.5mol/LCuSO4溶液+_________ NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
①实验Ⅵ的设计目的是:_______________________________________________
②其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:______________________________
③其中,实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:________________________________
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
1 | ||||||||||||||||||
2 | A | B | C | |||||||||||||||
3 | D | E | F | G | H | I | J | K | ||||||||||
4 | M | |||||||||||||||||
(1)在上表用字母标出的12种元素中,化学性质最不活泼的是____(用元素符号表示,下同),金属性最强的是___,除稀有气体外第三周期中原子半径最小的是____,属于过渡元素的是___(该空格用表中的字母表示)。
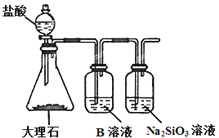
(2)J的氢化物的电子式为____,最高价氧化物对应的水化物的化学式为___。
(3)为比较元素A和G的非金属性强弱,用下图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_____,能说明A和G非金属性强弱的化学方程式是______。