题目内容
【题目】由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态Cl原子核外电子排布式为____,P、S、Cl的第一电离能由大到小顺序为____。
(2)SCl2分子中的中心原子杂化轨道类型是____,该分子构型为_____。
(3)Ni与CO能形成配合物Ni(CO)4,该分子中配位键个数为____;以“—”表示σ键、“→”表示配位键,写出Ni(CO)4分子的结构式____。
(4)已知MgO与NiO的晶体结构(如图)相同,其中Mg2+和Ni2+的离子半径分别为66 pm和69pm。则熔点:MgO_____NiO(填“>”、“<”或“=”),理由是____。
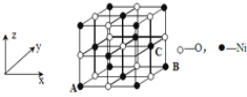
(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为____。
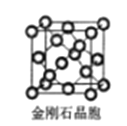
(6)金刚石晶胞含有___个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r= ______a,列式表示碳原子在晶胞中的空间占有率____(请用r和a表示不要求计算结果)。
【答案】1s22s22p63s23p5 Cl> P > S sp3 V形 8 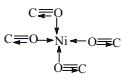 > Mg2+半径比Ni2+小,MgO的晶格能比NiO大 (1,1/2,1/2) 8
> Mg2+半径比Ni2+小,MgO的晶格能比NiO大 (1,1/2,1/2) 8 ![]()
![]()
【解析】
(1)Cl元素的原子序数为17,最外层的电子数为7;P元素原子3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
(2)SCl2分子中S原子的孤电子对数为2,价层电子对数为4;
(3)配合物Ni(CO)4分子中,Ni原子与4个CO分子形成4个配位键,CO分子中C与O形成1个配位键;
(4)由图可知MgO与NiO的晶体结构相同,同为离子晶体,离子晶体晶格能越大,熔点越高;
(5)根据NiO的晶胞结构,已知原子坐标A(0,0,0),B(1,1,0),C在右侧面心处;
(6)由金刚石的晶胞结构可知,晶胞内部有4个C原子,面心上有6个C原子,顶点有8个C原子,用“均摊法”确定金刚石晶胞中含有的碳原子数。根据硬球接触模型,晶胞体对角线等于碳原子半径的8倍。
(1)Cl元素的原子序数为17,最外层的电子数为7,基态Cl原子电子排布为1s22s22p63s23p5;同周期随原子序数增大,元素第一电离能呈增大趋势,P元素原子3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:Cl>P>S,故答案为:1s22s22p63s23p5;Cl> P > S;
(2)SCl2分子中S原子的孤电子对数为![]() ×(6-2×1)=2,价层电子对数为4,则S原子的杂化方式为sp3杂化,分子的空间构型为V形,故答案为:sp3;V形;
×(6-2×1)=2,价层电子对数为4,则S原子的杂化方式为sp3杂化,分子的空间构型为V形,故答案为:sp3;V形;
(3)配合物Ni(CO)4分子中,Ni原子与4个CO分子形成4个配位键,CO分子中C与O形成1个配位键,该分子的空间结构示意图为 ,由示意图可知分子中含有8个配位键,故答案为:8;
,由示意图可知分子中含有8个配位键,故答案为:8; ;
;
(4)由图可知MgO与NiO的晶体结构相同,同为离子晶体,离子晶体晶格能越大,熔点越高;Mg2+和Ni2+的离子半径分别为66pm和69pm,离子半径小,电荷越高,晶格能越大,则晶格能:MgO>NiO,熔点MgO>NiO,故答案为:>;Mg2+半径比Ni2+小, MgO的晶格能比NiO大;
(5)根据NiO的晶胞结构,已知原子坐标A(0,0,0),B(1,1,0),C在右侧面心处,根据立体几何知识可知C的原子坐标为(1,![]() ,
,![]() ),故答案为:(1,
),故答案为:(1,![]() ,
,![]() );
);
(6)由金刚石的晶胞结构可知,晶胞内部有4个C原子,面心上有6个C原子,顶点有8个C原子,所以金刚石晶胞中C原子数目为4+6×![]() +8×
+8×![]() =8;若C原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,晶胞体对角线等于碳原子半径的8倍,即
=8;若C原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,晶胞体对角线等于碳原子半径的8倍,即![]() a=8r,解得r=
a=8r,解得r=![]() a;晶胞的体积为a3,碳原子占据的体积为8×
a;晶胞的体积为a3,碳原子占据的体积为8×![]() πr3=8×
πr3=8×![]() π(
π(![]() a)3,碳原子在晶胞中的空间占有率为
a)3,碳原子在晶胞中的空间占有率为![]() =
= =
=![]() ,故答案为:
,故答案为:![]() ;
;![]() 。
。

 优生乐园系列答案
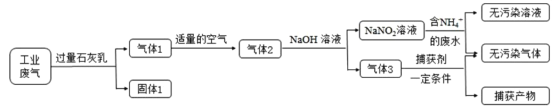
优生乐园系列答案【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

Ca2+ | Mg2+ | Fe3+ | ||
开始沉淀的pH | 11.9 | 9.1 | 1.9 | |
完全沉淀的pH | 13.9 | 11.1 | 3.2 | |
已知:室温条件下BaC2O4和CaC2O4均为沉淀,但BaC2O4的溶解度相对较大
(1)实验室用37%的盐酸配制1mol/L盐酸,下列仪器中,不需要使用的是_____
a.容量瓶 b.量筒 c.烧杯d.滴定管
(2)为了加快毒重石的酸浸速率,可以采取的措施有________________________(至少两条)。
(3)加入氨水调节溶液pH=8的目的是__________________。滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________________________________。
(4)操作Ⅳ的步骤是:___________、___________、过滤。
【题目】汽车尾气中的主要污染物为NOx、CO等有害物质。目前,已研究出了多种消除汽车尾气污染的方法。
I.催化剂存在时用H2将NO还原为N2。
已知:
则H2还原NO生成氮气和水蒸气的热化学方程式是:______________________________。
II.用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g)![]() N2(g)+CO2(g)△H=QkJ/mol,在2L恒容密闭器中加入足量的C与NO反应,所得实验数据如表
N2(g)+CO2(g)△H=QkJ/mol,在2L恒容密闭器中加入足量的C与NO反应,所得实验数据如表
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
(1)写出该反应的平衡常数表达式________________________________________。
(2)结合表中数据,判断该反应的Q___0(填“>”或“<”),理由是________________________。.
(3)用电子式表示产物CO2的形成过程_________________________________________。
(4)判断该反应达到平衡的依据是____________
a.若容器内气体密度恒定,反应达到平衡状态
b.若容器内各气体浓度恒定,反应达到平衡状态
c.若容器内压强恒定,反应达到平衡状态
d.若2υ正(NO)=υ逆(N2),反应达到平衡状态
【题目】磷是地壳中含量较为丰富的非金属元素,它的单质和化合物在工农业生产中应用广泛。白磷可通过反应 2Ca3(PO4)2+10C→6CaO+P4+10CO 获得。完成下列填空:
(1)磷原子的最外层电子排布式是__________,氧原子核外有______种不同运动状态的电子。C、O两种元素非金属性较强的是_______________。
(2)白磷在空气中露置时间长了会因温度达到____而自燃,使白磷升温的热量主要来自_________。某温度时,在2.0L恒容密闭容器中充入0.5mol PCl5,发生反应PCl5(g)![]() PCl3(g)+Cl2(g)-Q,经过一段时间后达到平衡。
PCl3(g)+Cl2(g)-Q,经过一段时间后达到平衡。
(3)该反应的平衡常数表达式 K=_____________;
(4)其他条件不变,起始时向上述容器中充入1.0 mol PCl5,达到平衡时,PCl5的转化率____(选填“增大”、 “减小”“不变”),平衡常数 K____(选填“增大”、 “减小”“不变”)。
(5)在不同时间(t)测得反应过程中 PCl5 的部分数据如下:
t(s) | 0 | 50 | 100 | 250 | 350 |
n(mol) | 0.5 | 0.42 | 0.41 | 0.40 | 0.40 |
则 100s 时, PCl3的物质的量浓度是__________________。