题目内容
12.下列说法中正确的是( )| A. | 向饱和Na2CO3溶液中通入过量的CO2,溶液中无明显现象 | |
| B. | 将8 g SO3 放入92 g水中,所得溶液溶质质量分数为8% | |
| C. | 已知H+(aq)+OH-(aq)═HO(l);△H=-57.3 kJ/mol.将4 g氢氧化钠固体放入100 mL 1 mol/L的稀盐酸中,放出了5.73 kJ的热量 | |
| D. | 向100 ml 1 mol/L的Ca(HCO3)2 溶液中加入等浓度等体积的NaOH溶液,溶液的碱性减弱 |
分析 A.向饱和Na2CO3溶液中通入过量的CO2,溶液变浑浊;
B.SO3与水反应生成H2SO4;
C.氢氧化钠固体溶于水放热;
D.向100ml1mol/L的Ca(HCO3)2溶液中加入等浓度等体积的NaOH溶液,生成CaCO3和NaHCO3
解答 解:A.向饱和Na2CO3溶液中通入过量的CO2,生成NaHCO3,由于NaHCO3的溶解度比Na2CO3的小,则溶液应变浑浊,故A错误;
B.SO3与水反应生成H2SO4,所得溶液溶质为H2SO4,质量分数为9.6%,故B错误;
C.氢氧化钠固体溶于水放热,将4g氢氧化钠固体放入100mL1mol/L的稀盐酸中,放出的热量大于5.73kJ,故C错误;
D.向100ml1mol/L的Ca(HCO3)2溶液中加入等浓度等体积的NaOH溶液,发生:Ca(HCO3)2+NaOH=CaCO3↓+NaHCO3+H2O,溶液HCO3-浓度减小,水解生成OH-的浓度减小,溶液的碱性减弱,故D正确.
故选D.
点评 本题考查较为综合,涉及盐类水解的应用、中和热以及离子反应等问题,题目难度中等,本题注意①NaHCO3的溶解度比Na2CO3的小,②氢氧化钠固体溶于水放热.

练习册系列答案
相关题目
20.能用离子方程式H++OH-═H2O来表示的化学反应是( )
| A. | 氢氧化镁和稀盐酸反应 | B. | Ba(OH)2溶液滴入稀硫酸中 | ||
| C. | 氢氧化钠溶液和稀硝酸反应 | D. | 二氧化碳通入澄清石灰水中 |
16.下列说法正确的是( )
①1mol氧元素
②0.25mol氯离子
③0.5mol 氢分子
氢氧化钠的摩尔质量是40g/mol
⑤0.1mol水分子中含有NA个质子和NA个电子
⑥0.25mol 氨气在标准状况下体积约为5.6升.
①1mol氧元素
②0.25mol氯离子
③0.5mol 氢分子
氢氧化钠的摩尔质量是40g/mol
⑤0.1mol水分子中含有NA个质子和NA个电子
⑥0.25mol 氨气在标准状况下体积约为5.6升.
| A. | 全部正确 | B. | ②③④⑤⑥ | C. | ①②③④⑥ | D. | ①③④⑤⑥ |
3.下列事实中,不能用勒•沙特列原理解释的是( )
| A. | 红棕色的NO2加压后颜色先变深后变浅(已知:2NO2 (g)?N2O4 (g)) | |
| B. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| C. | 对H2(g)+I2(g)?2HI(g),平衡体系增大压强可使颜色变深 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
 在25mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示
在25mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示 A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.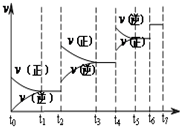 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)