题目内容
7. A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.请回答下列问题:
(1)C、D、E三种原子对应的离子半径由大到小的顺序是S2->O2->Na+(填具体离子符号);由A、B、C三种元素按 4:2:3组成的化合物所含的化学键类型属于离子键和共价键.
(2)用某种废弃的金属易拉罐与 A、C、D组成的化合物溶液反应,该反应的离子方程式为:2Al+2OH-+2H2O=2(AlOH2)-+3H2↑.
(3)A、C两元素的单质与熔融K2CO3,组成的燃料电池,其负极反应式为H2+CO32--2e-=CO2↑+H2O,用该电池电解1L1mol/LNaCl溶液,当消耗标准状况下1.12LA2时,NaCl溶液的PH=13 (假设电解过程中溶液的体积不变).
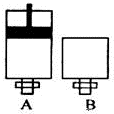
(4)可逆反应2EC2(气)+C2(气)?2EC3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B 容器可保持恒容 (如图所示),若在 A、B 中分别充入lmolC2和2molEC2,使V (A )=V ( B ),在相同温度下反应,则:①达平衡所需时间:t(A )< t ( B )(填>、<、二,或:无法确定,下同).平衡时 EC2的转化率:a( A ) _a( B ).
(5)欲比较C和E两元素的非金属性相对强弱,可采取的措施有cd (填“序号”).
a.比较这两种元素的气态氢化物的沸点
b.比较这两种元素的单质在常温下的状态
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素的单质与氢气化合的难易.
分析 A、B、C、D、E为原子序数依次增大的五种短周期元素,C与B、E在周期表中相邻,且C、E同主族,原子序数C大于A、B小于E,则C处于第二周期,E处于第三周期,所以B、C、E在周期表中的位置关系为 ,A和D最外层电子数相同,则二者处于同族,原子序数D大于C小于E,则D为第三周期,其中仅含一种金属元素,D应为金属,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,若D为钠元素,则A为氢元素,B为氮元素,C为氧元素,E为硫元素,A和C可形成化合物H2O、H2O2,符合题意.若D为铝元素,则A为硼元素,B为氧元素,C为氟元素,E为氯元素,A和C形成化合物,不符合题意.故A为氢元素,B为氮元素,C为氧元素,D为钠元素,E为硫元素,据此答题.
,A和D最外层电子数相同,则二者处于同族,原子序数D大于C小于E,则D为第三周期,其中仅含一种金属元素,D应为金属,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,若D为钠元素,则A为氢元素,B为氮元素,C为氧元素,E为硫元素,A和C可形成化合物H2O、H2O2,符合题意.若D为铝元素,则A为硼元素,B为氧元素,C为氟元素,E为氯元素,A和C形成化合物,不符合题意.故A为氢元素,B为氮元素,C为氧元素,D为钠元素,E为硫元素,据此答题.
解答 解:A、B、C、D、E为原子序数依次增大的五种短周期元素,C与B、E在周期表中相邻,且C、E同主族,原子序数C大于A、B小于E,则C处于第二周期,E处于第三周期,所以B、C、E在周期表中的位置关系为 ,A和D最外层电子数相同,则二者处于同族,原子序数D大于C小于E,则D为第三周期,其中仅含一种金属元素,D应为金属,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,若D为钠元素,则A为氢元素,B为氮元素,C为氧元素,E为硫元素,A和C可形成化合物H2O、H2O2,符合题意.若D为铝元素,则A为硼元素,B为氧元素,C为氟元素,E为氯元素,A和C形成化合物,不符合题意.故A为氢元素,B为氮元素,C为氧元素,D为钠元素,E为硫元素,
,A和D最外层电子数相同,则二者处于同族,原子序数D大于C小于E,则D为第三周期,其中仅含一种金属元素,D应为金属,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,若D为钠元素,则A为氢元素,B为氮元素,C为氧元素,E为硫元素,A和C可形成化合物H2O、H2O2,符合题意.若D为铝元素,则A为硼元素,B为氧元素,C为氟元素,E为氯元素,A和C形成化合物,不符合题意.故A为氢元素,B为氮元素,C为氧元素,D为钠元素,E为硫元素,
(1)C、D、E三种原子对应的离子为O2-、Na+、S2-,电子层数越多,半径越小,电子层数相同时,核电荷数越多,半径越小,所以它们半径由大到小的顺序是S2->O2->Na+,由A、B、C三种元素按 4:2:3组成的化合物为NH4NO3,所含的化学键类型属于离子键和共价键,
故答案为:S2->O2->Na+;离子键和共价键;
(2)废弃的金属易拉罐为铝,与A、C、D组成的化合物为氢氧化钠溶液反应,该反应的离子方程式为:2Al+2OH-+2H2O=2(AlOH2)-+3H2↑,
故答案为:2Al+2OH-+2H2O=2(AlOH2)-+3H2↑;
(3)氢气、氧气与熔融K2CO3,组成的燃料电池,氢气在负极放电,在熔融碳酸钾条件下生成二氧化碳与水,电解反应式为:H2+CO32--2e-=CO2↑+H2O;
用该电池电解1L1mol/LNaCl溶液,当消耗标准状况下1.12LH2时,氢气的物质的量=$\frac{1.12L}{22.4L/mol}$=0.05mol,生成的NaOH物质的量=0.05mol×2=0.1mol,故n(OH-)=0.1mol/L,则c(H+)=$\frac{1{0}^{-14}}{0.1}$=10-13,故l溶液的pH=-lg10-13=13,
故答案为:H2+CO32--2e-=CO2↑+H2O;13;
(4)可逆反应2EC2(气)+C2(气)?2EC3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B 容器可保持恒容 (如图所示),若在 A、B 中分别充入lmolC2 和2molEC2,使V(A )=V( B ),在相同温度下反应,则:A中压强不变,B中压强减小,故A反应速率更快,达平衡所需时间更短,故t(A)<t(B);A中的压强更高,增大压强平衡向正反应反应移动,平衡时 EC2 的转化率更高,故:a( A )>a( B ),
故答案为:<;>;
(5)a.沸点属于物理性质,不能比较元素的非金属性强弱,故a错误;
b.单质的状态属于物理性质,不能比较元素的非金属性强弱,故b错误;
c.气态氢化物的稳定性,元素的非金属性越强,可以利用氢化物稳定性比较,故c正确;
d.元素的单质与氢气化合的越容易,单质越活泼,元素的非金属性越强,故d正确;
故答案为:cd.
点评 本题考查结构与位置关系、半径比较、晶体类型与化学键、原电池、化学计算、化学平衡移动、非金属性比较等,难度中等,是对知识综合运用与学生能力考查,推断元素是关键,需充分利用信息,对知识全面掌握,物质推断是难点、易错点.

| A. | 葡萄糖和蔗糖 | B. | 蔗糖和麦芽糖 | C. | 淀粉和纤维素 | D. | 果糖和麦芽糖 |
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| C. | 稀盐酸与碳酸钠溶液反应:2H++CO32-═H2O+CO2↑ | |
| D. | 将铁粉加入稀硫酸中:2Fe+6 H+═2Fe3++3 H2↑ |
| A. | Al易导电,属于电解质 | |
| B. | BaSO4难溶于水,属于非电解质 | |
| C. | HCl的气体和液体都不导电,但HCl属于电解质 | |
| D. | SO2溶于水能导电,所以SO2是电解质 |
| A. | 向饱和Na2CO3溶液中通入过量的CO2,溶液中无明显现象 | |
| B. | 将8 g SO3 放入92 g水中,所得溶液溶质质量分数为8% | |
| C. | 已知H+(aq)+OH-(aq)═HO(l);△H=-57.3 kJ/mol.将4 g氢氧化钠固体放入100 mL 1 mol/L的稀盐酸中,放出了5.73 kJ的热量 | |
| D. | 向100 ml 1 mol/L的Ca(HCO3)2 溶液中加入等浓度等体积的NaOH溶液,溶液的碱性减弱 |
| A. | Na+、CO32-、Cu2+、SO42- | B. | K+、Fe3+、SO42-、OH- | ||
| C. | Ca2+、NO3-、Cl-、K+ | D. | Ba2+、K+、MnO4-、NO3- |
| A. | 将水加热,KW增大,pH不变 | |
| B. | 向水中加入少量NaHSO4固体,恢复到原温度,水的电离被抑制,C(H+) 增大 | |
| C. | 向水中加入少量NH4Cl固体,恢复到原温度,水的电离程度减小 | |
| D. | 向水中加少量KOH固体,恢复到原温度,水的电离程度增大 |

 .
.