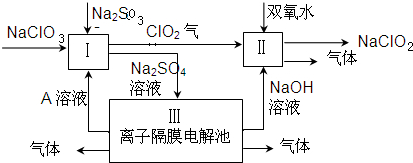
题目内容
4.含有离子键的物质是( )| A. | Cl2 | B. | H2O | C. | CO2 | D. | NaCl |
分析 活泼金属和活泼金属元素之间易形成离子键,非金属元素之间易形成共价键,碱金属族元素、碱土金属族元素和氧族、卤族元素之间易形成离子键,据此分析解答.
解答 解:A.氯气分子中Cl-Cl原子之间只存在共价键,故A错误;
B.水分子中H-O原子之间只存在共价键,故B错误;
C.二氧化碳分子中C-O原子之间只存在共价键,故C错误;
D.氯化钠中钠离子和氯离子之间只存在离子键,故D正确;
故选D.
点评 本题考查离子键和共价键判断,侧重考查基本概念,明确离子键和共价键的区别是解本题关键,注意不能根据是否含有金属元素判断离子键,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g)?2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
| A. | A、B、C的分子数之比为1:3:2 | |
| B. | A、B、C的浓度相等 | |
| C. | 单位时间生成 nmol A,同时生成 3nmol B | |
| D. | 生成C的速率与C分解的速率相等 |
15.下列氧化物不能跟铝粉组成铝热剂的是( )
| A. | Fe2O3 | B. | MnO2 | C. | CaO | D. | V2O5 |
12.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 煤的干馏和石油的分馏均属化学变化 | |
| B. | 蛋白质和蔗糖都属于高分子化合物,一定条件下都能水解 | |
| C. | 乙烯水化成乙醇,原子利用率为百分之百,符合绿色化学原理 | |
| D. | 淀粉与纤维素互为同分异构体 |
19.氢-氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,根据原电池原理判断下列叙述正确的是( )
| A. | 负极反应:H2-2e-═2 H+ | |
| B. | 通O2的一极是发生还原反应 | |
| C. | 工作一段时间后电解质溶液的c(OH-)增大 | |
| D. | 工作时负极区附近pH增大 |
9.与500mL1mol/LNaNO3中的NO3-浓度相等的是( )
| A. | 100mL 2mol/L NH4NO3溶液 | B. | 40mL 0.5mol/L Ca(NO3)2溶液 | ||
| C. | 50mL 1.5mol/L Al(NO3)3溶液 | D. | 150mL 1mol/L Mg(NO3)2溶液 |
16.下列有关能量变化的说法中错误的是( )
| A. | 化学反应必伴随能量变化 | |
| B. | 反应是放热还是吸热须看反应物和生成物具有的总能量的相对大小 | |
| C. | Ba(OH)2•8H2O和NH4Cl(固体)混合搅拌发生的是吸热反应 | |
| D. | 燃煤发电不需经过其它能量转换过程,可直接把化学能转化为电能 |
14.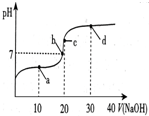 常温下,向20mL 0.1mol/L 醋酸溶液中滴加0.1mol/L NaOH溶液,溶液的pH变化如图所示.下列关于溶液中微粒浓度大小关系说法正确的是( )
常温下,向20mL 0.1mol/L 醋酸溶液中滴加0.1mol/L NaOH溶液,溶液的pH变化如图所示.下列关于溶液中微粒浓度大小关系说法正确的是( )
 常温下,向20mL 0.1mol/L 醋酸溶液中滴加0.1mol/L NaOH溶液,溶液的pH变化如图所示.下列关于溶液中微粒浓度大小关系说法正确的是( )
常温下,向20mL 0.1mol/L 醋酸溶液中滴加0.1mol/L NaOH溶液,溶液的pH变化如图所示.下列关于溶液中微粒浓度大小关系说法正确的是( )| A. | a点时:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | b点时:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) | |
| C. | c点时:c(H+)=c(CH3COOH)+c(OH-) | |
| D. | d点时:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |