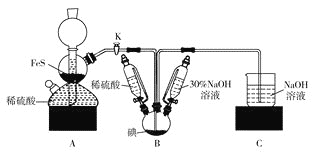
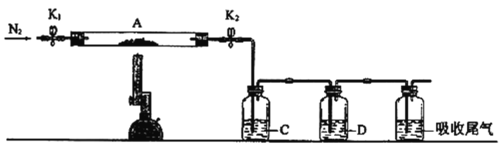
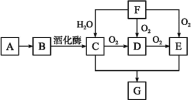
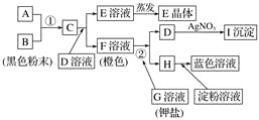
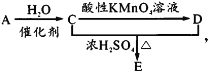
题目内容
【题目】己知ROH固体溶于水放热,有关过程的能量变化如图(R=Na、K):
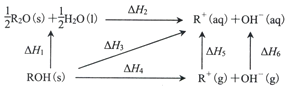
下列说法正确的是
A.△H1+△H2>0B.△H4(NaOH)>△H4(KOH)>0
C.△H6(NaOH>△H6(KOH)D.△H1+△H2+△H4+△H5+△H6=0
【答案】B
【解析】
A. △H1+△H2表示ROH固体溶于水过程,该过程放热,所以应小于0,故错误;
B. △H4表示ROH破坏离子键的过程,因为氢氧化钠中钠离子半径比钾离子半径小,所以破坏离子键吸收的能量氢氧化钠多,即△H4(NaOH)>△H4(KOH)>0,故正确;
C. △H6都表示氢氧根离子从气态变液体,能量应相同,故错误;
D. 根据盖斯定律分析,有△H1+△H2=△H4+△H5+△H6,因为ROH固体溶于水过程放热,故△H1+△H2+△H4+△H5+△H6不等于0,故错误。
故选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目