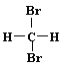
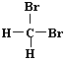
题目内容
【题目】根据下图所示的转化关系,回答下列问题:
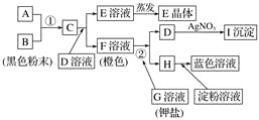
(1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。
(2)推出下列物质的化学式:E____________;I______________。
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。
【答案】MnO2+2Cl-+4H+![]() Mn2++Cl2↑+2H2O Br2+2I-===2Br-+I2 KCl AgBr I2<Br2<Cl2<MnO2
Mn2++Cl2↑+2H2O Br2+2I-===2Br-+I2 KCl AgBr I2<Br2<Cl2<MnO2
【解析】
H中加入淀粉溶液变蓝,说明H为I2单质,F溶液为橙色,应为溴水,即F是Br2单质,其通过反应②即加入G(钾盐)溶液后有单质I2生成,说明G溶液一定是KI溶液,则D为KBr,因为C+KBr→Br2+E,很容易联想到卤素间的置换反应,比Br2单质氧化性强的应是Cl2,所以C应该是Cl2,B为黑色粉末,可想到A和B的反应是制Cl2的反应,则A为HCl,E为KCl,I为AgBr。
(1)反应①是实验室制氯气反应,离子方程式为:MnO2+2Cl-+4H+![]() Mn2++Cl2↑+2H2O,反应②是Br2与I-的置换反应,反应的方程式为:Br2+2I-===2Br-+I2,故答案为:MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O,反应②是Br2与I-的置换反应,反应的方程式为:Br2+2I-===2Br-+I2,故答案为:MnO2+2Cl-+4H+![]() Mn2++Cl2↑+2H2O;Br2+2I-===2Br-+I2
Mn2++Cl2↑+2H2O;Br2+2I-===2Br-+I2
(2)C为Cl2,Cl2与KBr反应生成Br2和KCl,所以E为KCl,D为KBr与AgNO3反应生成AgBr沉淀,所以I为AgBr,故答案为:KCl;AgBr。
(3)B、C、F、H分别为:MnO2、Cl2、Br2、I2,根据氧化剂的氧化性大于氧化产物的氧化性,可以推出氧化能力由弱到强的顺序为I2<Br2<Cl2<MnO2,故答案为:I2<Br2<Cl2<MnO2

【题目】铬铁矿(FeCr2O4)中含有Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程示意图如下(部分操作和条件略):
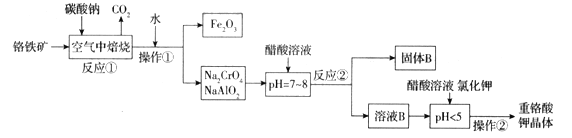
(1)铬铁矿(FeCr2O4)改写为氧化物的形式为___________________。
(2)反应①中发生了两个主要反应,其中一个主要反应的化学方程式为4FeCr2O4+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ______________________________。
8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ______________________________。
(3)写出反应②中生成固体B的离子方程式为_________________________________。
(4)pH < 5时,发生反应有____________________________________(写离子方程式),Na2Cr2O7 + 2KCl = K2Cr2O7↓+ 2NaCl。
下表是相关物质的溶解度数据:
物质 | 溶解度 ( g / 100 g H2O ) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
获得K2Cr2O7晶体的操作由多步组成,依次是加入KCl固体、蒸发浓缩、________________、_____________、洗涤、干燥得到晶体。
(5)某种酒精测试仪中,K2Cr2O7在酸性条件下将乙醇氧化为乙酸,自身被还原为三价铬离子,该反应的氧化剂与还原剂的物质的量比为_________________。
(6)含铬废渣(废水)的随意排放对环境有极大危害,电解法是处理铬污染的一种方法,电解时,在阴极区有Fe(OH)3和Cr(OH)3沉淀生成(已知Ksp[Fe(OH)3] = 4.0×10-38,KspCr(OH)3] = 6.0×10-31)。已知电解后的溶液中c(Cr3+)为3.0×10-5mol/L,则溶液中c(Fe3+)为________________ mol/L。