题目内容
【题目】X、Y、Z、W四种元素是周期表前四周期元素,X元素原子核外有16种不同运动状态的电子,Y的原子序数比X大1,Z原子的M能层上有4个未成对电子,W的价层电子排布式为ndn+5(n+1)sn-1。
(1)Z的最外层电子轨道排布图为__;W元素的名称为__。
(2)XY2分子中X原子的杂化轨道类型为__;XO32-的空间构型为__。
(3)第一电离能X__Z(填“>”、“<”或“=”,下同);氢化物稳定性X__Y。
(4)配位化合物是中心金属原子或离子提供空轨道,配体提供孤电子对,以配位键结合而形成的一类化合物,中心原子或离子接受的鬼电子对数,称为配位数,则配位化合物[W(NH3)4(H2O)2]Cl2中,中心W2+的配位数为__;其结构中不含有的作用力有___。
A.极性键 B.非极性键 C.配位键 D.离子键
(5)金属Z的单质的晶胞结构如图:
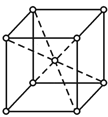
①区别晶体和非晶体的最科学的方法是__。
②上述金属晶体原子堆积模型为__型,其原子的空间利用率为__。
③若Z的摩尔质量为Mg/mol,密度为ρg/cm3,则Z的原子半径为___cm(列出算式即可)。
(6)已知:晶格能越大,离子晶体越稳定.则CaO、MgO、NaCl的稳定性由大到小的顺序为___。
【答案】![]() 镍 sp3 三角锥形 > < 6 B 对固体进行X-射线衍射实验 体心立方堆积 68%
镍 sp3 三角锥形 > < 6 B 对固体进行X-射线衍射实验 体心立方堆积 68% 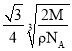 MgO>CaO>NaCl
MgO>CaO>NaCl
【解析】
X、Y、Z、W四种元素是周期表前四周期元素,X元素原子核外有16种不同运动状态的电子,则X为S,Y的原子序数比X大1,则Y为Cl,Z原子的M能层上有4个未成对电子,则Z为Fe,W的价层电子排布式为![]() ,则
,则![]() ,所以W为Ni。
,所以W为Ni。
(1)![]() 为Fe,Z的最外层电子轨道排布图为
为Fe,Z的最外层电子轨道排布图为![]() ,W为Ni,W元素的名称为镍,
,W为Ni,W元素的名称为镍,
故答案为:![]() ;镍;
;镍;
(2)![]() 分子中S原子的价层电子对数为
分子中S原子的价层电子对数为![]() ,所以S的杂化轨道类型为
,所以S的杂化轨道类型为![]() 杂化,
杂化,![]() 中硫原子的价层电子对数为
中硫原子的价层电子对数为![]() ,有一对孤电子对,所其空间构型为三角锥形,
,有一对孤电子对,所其空间构型为三角锥形,
故答案为:![]() ;三角锥形;
;三角锥形;
(3)元素非金属性越强,第一电离能越大,所以S的第一电离能![]() 的第一电离能,元素非金属性越强,气态氢化物越稳定,所以氢化物稳定性
的第一电离能,元素非金属性越强,气态氢化物越稳定,所以氢化物稳定性![]() ,
,
故答案为:![]() ;
;![]() ;
;
(4)根据配位化合物![]() 的组成可知,中心
的组成可知,中心![]() 的配位数为6;其结构中不含非极性键,故选B,
的配位数为6;其结构中不含非极性键,故选B,
故答案为:6;B;
(5)①区别晶体和非晶体的最科学的方法是对固体进行![]() 射线衍射实验,
射线衍射实验,
故答案为:对固体进行![]() 射线衍射实验;
射线衍射实验;
②根据Fe的晶胞结构可知,Fe晶体原子堆积模型为体心立方堆积,体心立方中含有铁原子数为![]() ;设铁原子半径为r,晶胞中铁原子的体积为:
;设铁原子半径为r,晶胞中铁原子的体积为:![]() ;体心立方中,体对角线上为三个铁原子相切,则体对角线为4r,晶胞边长为:
;体心立方中,体对角线上为三个铁原子相切,则体对角线为4r,晶胞边长为:![]() ,空间利用率为:
,空间利用率为: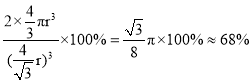 ,
,
故答案为:体心立方堆积;![]() ;
;
③设铁原子半径为r,根据![]() 中分析可知中,晶胞边长为:
中分析可知中,晶胞边长为:![]() ,晶胞中含有铁原子数为
,晶胞中含有铁原子数为![]() ,根据
,根据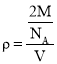 可知,
可知,![]() ,所以
,所以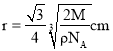 ,
,
故答案为: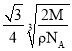 ;
;
(6)由于钙离子的半径大于镁离子,氧化钙中离子所带电荷大于氯化钠,所以晶格能大小顺序为![]() ,所以CaO、MgO、NaCl的稳定性由大到小的顺序为
,所以CaO、MgO、NaCl的稳定性由大到小的顺序为![]() ,
,
故答案为:![]() 。
。

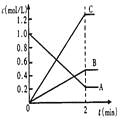
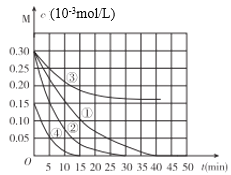
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果.设计如下对比实验探究温度、浓度、pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是( )
实验编号 | 温度°C | pH |
① | 25 | 1 |
② | 45 | 1 |
③ | 25 | 7 |
④ | 25 | 1 |
A.实验①在15min内M的降解速率为1.33×10-5mol/(L·min)
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.实验①④说明M的浓度越小,降解的速率越快