题目内容
【题目】电导率可用于衡量电解质溶液导电能力的大小。向10mL 0.3 mol·L-1Ba(OH)2溶液滴入0.3 mol·L-1 NH4HSO4溶液,其电导率随滴入的NH4HSO4溶液体积的变化如图所示(忽略BaSO4溶解产生的离子)。下列说法不正确的是

A.a→e的过程水的电离程度逐渐增大
B.b点:c(Ba2+) =0.1 moI.L-1
C.c点:c(NH4+)<c(OH-)
D.d点:c(SO42-)+c(H+)>c(OH-)+c(NH3H2O)
【答案】D
【解析】
ac段电导率一直下降,是因为氢氧化钡和硫酸氢铵反应生成硫酸钡沉淀和一水合氨,c点溶质为一水合氨,ce段电导率增加,是一水合氨和硫酸氢铵反应生成硫酸铵,溶液中的离子浓度增大。
A. a→e的过程为碱溶液中加入盐,水的电离程度逐渐增大,故正确;
B. b点c(Ba2+) = ![]() =0.1 moI.L-1,故正确;
=0.1 moI.L-1,故正确;
C. c点的溶质为一水合氨,一水合氨电离出铵根离子和氢氧根离子,水也能电离出氢氧根离子,所以有c(NH4+)<c(OH-),故正确;
D. d点溶液为等物质的量的一水合氨和硫酸铵,电荷守恒有①c(NH4+)+ c(H+)= 2c(SO42-)+ c(OH-),物料守恒有②c(NH4+)+ c(NH3H2O)=3 c(SO42-),②-①可得c(SO42-)+c(H+)=c(OH-)+c(NH3H2O),故错误。
故选D。

 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果.设计如下对比实验探究温度、浓度、pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是( )
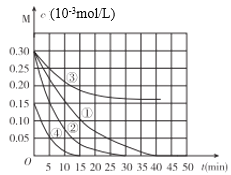
实验编号 | 温度°C | pH |
① | 25 | 1 |
② | 45 | 1 |
③ | 25 | 7 |
④ | 25 | 1 |
A.实验①在15min内M的降解速率为1.33×10-5mol/(L·min)
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.实验①④说明M的浓度越小,降解的速率越快
【题目】类比法是一种常用的化学思维,下列各项中类比结论正确的是
选项 | 已知 | 类比结论 |
A | 强碱弱酸盐 |
|
B |
|
|
C | 用惰性电极电解熔融的 | 用惰性电极电解熔融的 |
D |
|
|
A.AB.BC.CD.D