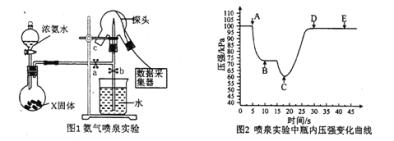
题目内容
【题目】为探究硫酸亚铁的分解产物,将已加热至恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
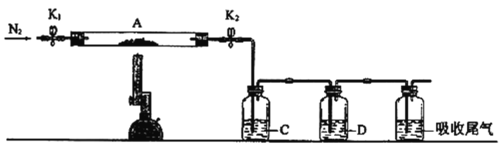
①C、D中的溶液依次为___、___(填标号)。C、D中有气泡冒出,并可观察到的现象分别为___。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式___。
【答案】c a 产生白色沉淀、品红褪色 2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
【解析】
实验后反应管中残留固体为红色粉末,说明生成Fe2O3,则反应中Fe元素化合价升高,根据氧化还原反应的规律,S元素化合价应降低,因此一定生成SO2;根据化合价升降守恒,化合价降低的S元素为总量的一半,因此一定还生成SO3,结合物质的性质分析解答。
①硫酸亚铁的分解产物产生了氧化铁,二氧化硫和三氧化硫,即检验气体存在时需要先排除三氧化硫的干扰,检验二氧化硫可以选用品红溶液,检验三氧化硫,可以选用氯化钡溶液,三氧化硫易溶于水,显酸性,故选用Ba(NO3)2会氧化二氧化硫气体,使实验出现误差,因此C为氯化钡,用于检验SO3,可观察到产生白色沉淀,D为品红,可用于检验SO2,品红褪色;。
②硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,反应的方程式为2FeSO4![]() Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目