题目内容
1.某同学欲证明乙炔能与KMnO4酸性溶液反应,实验方案如下:将电石与水反应生成的气体通入KMnO4酸性溶液,溶液褪色,证明二者发生了反应.请回答:(1)制备乙炔的反应的化学方程式是CaC2+2H2O→Ca(OH)2+HC≡CH↑.
(2)该同学的实验方案存在的问题是电石含有杂质,反应产生其他还原性气体,干扰乙炔的检验,应除杂.
(3)为了解决上述问题,需重新选择实验装置,备选装置如图所示.

①将装置编号按顺序填在横线上C→ B→D.
①B装置中所盛放的试剂是硫酸铜溶液.
分析 (1)碳化钙与水反应生成氢氧化钙和乙炔;
(2)乙炔中混有杂质硫化氢,也能被高锰酸钾氧化;
(3)制备乙炔后,先利用硫酸铜溶液除杂,再利用高锰酸钾褪色检验乙炔,以此来解答.
解答 解:(1)碳化钙与水反应生成氢氧化钙和乙炔,该反应为CaC2+2H2O→Ca(OH)2+HC≡CH↑,故答案为:CaC2+2H2O→Ca(OH)2+HC≡CH↑;
(2)该同学的实验方案存在的问题是电石含有杂质,反应产生其他还原性气体,干扰乙炔的检验,应除杂,故答案为:电石含有杂质,反应产生其他还原性气体,干扰乙炔的检验,应除杂;
(3)①固体与液体反应制备乙烯,选择装置C,再利用B装置除杂,最后利用D装置检验乙炔,故答案为:C;D;
①B装置除去硫化氢,则所盛放的试剂是硫酸铜溶液,故答案为:硫酸铜溶液.
点评 本题考查制备与性质实验及化学实验综合,为高频考点,把握乙炔的制备原理、性质及实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
11.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | NA个氧分子和NA个氢分子的质量比等于8:1 | |
| B. | 11.2L H2中含有的原子数为NA个 | |
| C. | 54g H2O中含有分子数为3NA个 | |
| D. | 1mol/L Na2SO4溶液中SO42-离子数为NA个 |
12.下列分子式表示的物质一定是纯净物的是( )
| A. | C5H10 | B. | C4H10 | C. | CH2Cl2 | D. | C2H4Cl2 |
9.下列电子式书写正确的是( )
| A. | OH- | B. | 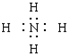 | C. | 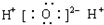 | D. |  |
16.废电池必须进行集中处理的首要原因是( )
| A. | 防止电池中汞、镉和铅等重金属离子污染土壤和水源 | |
| B. | 回收利用石墨电极和金属材料 | |
| C. | 充电后可再使用 | |
| D. | 防止电池中的电解质溶液腐蚀其他物品 |
6.下列烷烃的一氯代物中没有同分异构体的是( )
| A. | 丁烷 | B. | 丙烷 | C. | 乙烷 | D. | 2-甲基丙烷 |
20.下列各物质中,最简式相同,但既不是同系物,又不是同分异构体的是( )
| A. | 丙烯和环己烷 | B. | 乙烯和己烯 | C. | 乙烷和苯 | D. | 正丁烷和异丁烷 |