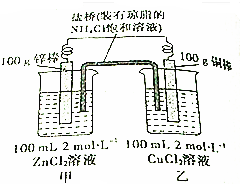
题目内容
20.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )| A. | 原子半径:A>B>C>D | |
| B. | 离子半径:D(n+1)->Cn->B(n+1)+>An+ | |
| C. | 原子序数:b>a>c>d | |
| D. | 金属性:B>A,气态氢化物稳定性:D>C |
分析 已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,由形成的离子可知,A、B为金属,C、D为非金属性,结合元素周期律递变规律解答该题.
解答 解:已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,由形成的离子可知,A、B为金属,C、D为非金属性,则:
A.A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,原子核外电子层数越多,原子半径越大,同周期元素原子序数越大,原子半径越小,则有原子半径:A>B>D>C,故A错误;
B.aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,核电荷数越大离子半径越小,核电荷数b>a>c>d,故离子半径dD(n+1)->cCn->aAn+>bB(n+1),故B错误;
C.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有原子序数:b>a>c>d,故C正确;
D.A、B在周期表中同周期,原子序数:b>a,金属性:A>B.C、D在同一周期,且原子序数C>D,非金属性:C>D,则气态氢化物的稳定性:C>D,故D错误,
故选C.
点评 本题考查位置结构性质关系及应用,关键是根据核外电子排布确定元素所在周期表中的相对位置,注意对元素周期律的理解掌握,难度不大.

练习册系列答案
相关题目
10.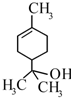 萜品醇可作为消毒剂、抗氧化剂、医药和溶剂.已知α-萜品醇的结构简式如下式,则下列说法错误的是( )
萜品醇可作为消毒剂、抗氧化剂、医药和溶剂.已知α-萜品醇的结构简式如下式,则下列说法错误的是( )
 萜品醇可作为消毒剂、抗氧化剂、医药和溶剂.已知α-萜品醇的结构简式如下式,则下列说法错误的是( )
萜品醇可作为消毒剂、抗氧化剂、医药和溶剂.已知α-萜品醇的结构简式如下式,则下列说法错误的是( )| A. | 分子式为C9H18O | |
| B. | 分子中含有的官能团为羟基和碳碳双键 | |
| C. | 该物质能和乙酸发生取代反应 | |
| D. | 1mol该物质最多能和1mol氢气发生加成反应 |
11.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | NA个氧分子和NA个氢分子的质量比等于8:1 | |
| B. | 11.2L H2中含有的原子数为NA个 | |
| C. | 54g H2O中含有分子数为3NA个 | |
| D. | 1mol/L Na2SO4溶液中SO42-离子数为NA个 |
5.下列说法正确的是( )
| A. | 用BaCl2 溶液可证明Na2CO3溶液显碱性时由于CO32-发生水解 | |
| B. | NaHCO3 溶液中存在:c(Na+ )=c(HCO3-)+c(CO3 2-) | |
| C. | CH3COOH溶液中加入少量CH3COONa 固体后溶液中c(H+)•c(CH3COO-)增大 | |
| D. | 相同温度下,Ksp较小的物质其溶解度也一定较小 |
12.下列分子式表示的物质一定是纯净物的是( )
| A. | C5H10 | B. | C4H10 | C. | CH2Cl2 | D. | C2H4Cl2 |
9.下列电子式书写正确的是( )
| A. | OH- | B. | 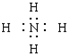 | C. | 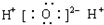 | D. |  |

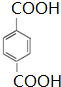 .
. +2Br2
+2Br2 +2HBr.?
+2HBr.?
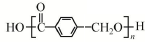 +(n-1)H2O.
+(n-1)H2O.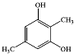 .
.