题目内容
19.有A、L、Z、W、Q五种短周期元素,其中Z、Q同主族,A、L、Z、W同周期;A+与Q2-具有相同的电子层结构; L的单质晶体熔点高、硬度大,是一种重要的半导体材料;离子半径:Z2->W-.下列说法中,正确的是( )| A. | 元素L、Z、W的单质晶体属于同种类型的晶体 | |
| B. | 由于W、Z、Q元素的氢化物相对分子质量依次减小,所以其沸点依次降低 | |
| C. | A、Q两种元素能形成A2Q和A2Q2型化合物 | |
| D. | 元素W和Q的某些单质不可以作为水处理中的消毒剂 |
分析 根据L的单质晶体熔点高、硬度大,是一种重要的半导体材料可知L为Si,则A、Z、W都在第三周期,再由A+与Q2-具有相同的电子层结构,则A为Na元素,Q为O元素;Z、Q同主族,则Z为S元素;离子半径:Z2->W-,而且Z、W同周期,则W为Cl元素,然后利用元素形成的化合物的结构和性质来解答.
解答 解:由L的单质晶体熔点高、硬度大,是一种重要的半导体材料可知L为Si,则A、Z、W都在第三周期,再由A+与Q2-具有相同的电子层结构,则A为Na元素,Q为O元素;Z、Q同主族,则Z为S元素;离子半径:Z2->W-,而且Z、W同周期,则W为Cl元素;
A.元素L、Z、W分别为Si、S、Cl,其单质晶体分别为原子晶体、分子晶体、分子晶体,故A错误;
B.O元素的氢化物中含有氢键,沸点较高,则氢化物的沸点H2O>HCl>H2S,故B错误;
C.钠和氧可以形成Na2O2和Na2O,故C正确;
D.Cl2和O3都具有强氧化性,则可以作为水处理中的消毒剂,故D错误.
故选C.
点评 本题考查位置、结构、性质的关系和应用,寻找本题的突破点为Y是解答本题的关键,然后利用元素化合物知识来解答即可.

练习册系列答案
相关题目
10.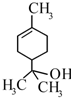 萜品醇可作为消毒剂、抗氧化剂、医药和溶剂.已知α-萜品醇的结构简式如下式,则下列说法错误的是( )
萜品醇可作为消毒剂、抗氧化剂、医药和溶剂.已知α-萜品醇的结构简式如下式,则下列说法错误的是( )
 萜品醇可作为消毒剂、抗氧化剂、医药和溶剂.已知α-萜品醇的结构简式如下式,则下列说法错误的是( )
萜品醇可作为消毒剂、抗氧化剂、医药和溶剂.已知α-萜品醇的结构简式如下式,则下列说法错误的是( )| A. | 分子式为C9H18O | |
| B. | 分子中含有的官能团为羟基和碳碳双键 | |
| C. | 该物质能和乙酸发生取代反应 | |
| D. | 1mol该物质最多能和1mol氢气发生加成反应 |
7.某原电池的总反应是:Zn+Cu2+═Zn2++Cu,此反应的原电池的正确组成是( )
| 正极 | 负极 | 电解质溶液 | |
| A | Cu | Zn | HCl |
| B | Zn | Cu | CuSO4 |
| C | Cu | Zn | CuSO4 |
| D | Cu | Zn | ZnCl2 |
| A. | A | B. | B | C. | C | D. | D |
14.如图原电池装置,当装置电路中通过2mol电子时,Cu电极( )
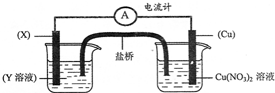

| A. | 一定增重64g | B. | 一定减重64g | ||
| C. | 可能增重64g,也可能减重64g | D. | 既不增重也不减重 |
4.某混合气体中可能含有N2、O2、SO2、NO、NO2 中的两种或多种气体.现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色.对于原混合气体成分的判断中正确的是( )
| A. | 肯定有SO2 和NO | B. | 肯定没有N2、O2和NO2 | ||
| C. | 可能有Cl2和O2 | D. | 肯定只有NO |
11.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | NA个氧分子和NA个氢分子的质量比等于8:1 | |
| B. | 11.2L H2中含有的原子数为NA个 | |
| C. | 54g H2O中含有分子数为3NA个 | |
| D. | 1mol/L Na2SO4溶液中SO42-离子数为NA个 |
9.下列电子式书写正确的是( )
| A. | OH- | B. | 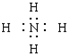 | C. | 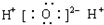 | D. |  |
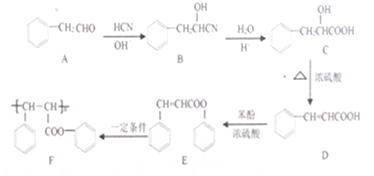
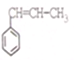 系统命名为1-苯基丙烯,则D的名称(系统命名)是3-苯基丙烯酸.
系统命名为1-苯基丙烯,则D的名称(系统命名)是3-苯基丙烯酸.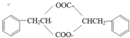 ;其在相同条件下还可能生成一种高聚酯类化合物,写出该反应的化学方程式
;其在相同条件下还可能生成一种高聚酯类化合物,写出该反应的化学方程式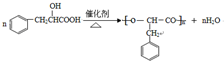 .
.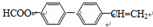 .
.
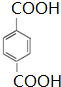 .
. +2Br2$\stackrel{光照}{→}$
+2Br2$\stackrel{光照}{→}$ +2HBr.?
+2HBr.? $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$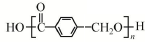 +(n-1)H2O.
+(n-1)H2O. .
.