题目内容
【题目】4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性,回答下列问题: 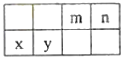
(1)元素x在周期表中的位置是第周期,第族,其单质可采用电解熔融的方法制备.
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是 , 碱性最强的是 . (填化学式)
(3)气体分子(mn)2的电子式为 . (mn)2成为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为 .
【答案】
(1)三;IIA;氯化镁
(2)HNO3;Al(OH)3
(3)![]() ;2NaOH+(CN)2=NaCN+NaCNO+H2O
;2NaOH+(CN)2=NaCN+NaCNO+H2O
【解析】解:这几种元素都是短周期元素,且为相邻主族,根据元素在周期表中的位置知,m和n位于第二周期、x和y位于第三周期,x原子核外电子数是m的2倍,y的氧化物具有两性,则y是Al元素,根据元素位置知,x是Mg元素、m是C元素、n元素N元素,(1)元素x是Mg元素,在周期表中的位置是第三周期第IIA族,其单质可以采用电解熔融氯化镁的方法制备, 所以答案是:三;IIA;氯化镁;(2)m、n、y分别是C、N、Al,元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,这三种元素金属性最强的是Al元素、非金属性最强的是N元素,所以酸性最强的是HNO3 , 碱性最强的是Al(OH)3 , 所以答案是:HNO3;Al(OH)3;(3)气体分子(mn)2为(CN)2 , 电子式为 ![]() ,根据氯气和氢氧化钠溶液反应知,(CN)2和NaOH反应生成NaCN、NaCNO、H2O,反应方程式为2NaOH+(CN)2=NaCN+NaCNO+H2O,所以答案是:
,根据氯气和氢氧化钠溶液反应知,(CN)2和NaOH反应生成NaCN、NaCNO、H2O,反应方程式为2NaOH+(CN)2=NaCN+NaCNO+H2O,所以答案是: ![]() ;2NaOH+(CN)2=NaCN+NaCNO+H2O.
;2NaOH+(CN)2=NaCN+NaCNO+H2O.