题目内容
【题目】现有一瓶甲和乙的混合液,已知甲和乙的某些性质如表所示:
物质 | 熔点/℃ | 沸点/℃ | 密度/(g·cm3) | 溶解性 |
甲 | 68 | 115 | 0.93 | 易溶于乙 |
乙 | 84 | 77 | 0.90 | 易溶于甲 |
据此,将甲和乙相互分离的最佳方法是
A.过滤法 B.蒸发法
C.萃取法 D.蒸馏法
【答案】D
【解析】对于两种互溶的液体混合物,宜利用沸点不同采用蒸馏方法分离。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】表为元素周期表的一部分,其中的编号代表所对应的元素.请回答下列问题: 
(1)⑧号元素的基态原子的价电子排布式是 , 与其同周期,且基态原子的核外未成对电子数最多的元素是(写出元素符号).
(2)④号与⑦号元素形成的氧化物的熔点由高到低的是 .
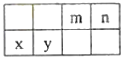
(3)①号与③号元素形成的含有18电子的分子为(写出名称),该分子中③号元素的原子的杂化方式为 . ②、④、⑧三种元素的原子形成的晶体,其晶胞的结构特点如图所示,则该化合物的化学式为(用对应的元素符号表示). 
(4)下表是某些短周期元素的电负性值:
元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
电负性 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.1 |
①通过分析电负性值变化规律,确定N最接近的电负性值范围:<N< .
②推测电负性值与原子半径关系是 .
③试推断:AlBr3中化学键类型是 .
【题目】硝基苯甲酸乙酯在OH﹣存在下发生水解反应: O2NC6H4COOC2H5+OH﹣O2NC6H4COO﹣+C2H5OH
两种反应物的初始浓度均为0.050molL﹣1 , 15℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示.回答下列问题:
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
α/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
(1)列示计算该反应在120~180s与180~240s区间的平均反应速率、;比较两者大小可得出的结论是 .
(2)列式计算15℃时该反应的平衡常数 .
(3)为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可采取的措施有(要求写出两条).