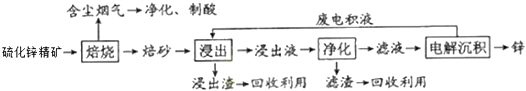
��Ŀ����
����Ŀ�����������н�50mL��0.50molL��1CH3COOH��Һ��50mL��0.55molL��1NaOH��Һ��ϣ��¶ȴ�25.16�����ߵ�27.46�森��֪���ȼƵ����ݳ��������ȼƸ�����ÿ����10C�������������150J0C��1 �� C=4.18Jg��10C��1 �� ��Һ���ܶ�Ϊ1gcm��3 �� 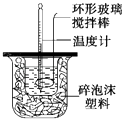
��1������CH3COOH�ġ��к��ȡ���
��2�����������1���в�õ�ʵ��ֵƫ�������ʲôԭ����ɵģ� ��
��3����HNO3 ��aq��+NaOH��aq��=NaNO3��aq��+H2O��l������H=��57.3KJmol��1��
���Т�ϡH2SO4��Ba��OH��2��aq�� ��ŨH2SO4��Ba��OH��2��aq��
��HNO3��Ba��OH��2��aq����Ӧ����1molH2O��l�� �ķ�Ӧ�ȷֱ�Ϊ��H1����H2����H3 ��
���H1����H2����H3������С����Ĺ�ϵΪ�� ��
���𰸡�
��1���⣺�¶Ȳ��t=27.46�橁25.16��=2.3�棬Q=cm��t=2.3���4.18J/��g�棩��100g+150J0C��1��2.3��=1306.4J=1.31kJ����H= ![]() =
= ![]() =��52.4kJ/mol��
=��52.4kJ/mol��
��CH3COOH���к��ȡ�H=��53.3 kJ/mol
��2�������ȼƵı���ƿЧ�����ã����������Ҫ����
��3����H2����H1����H3
���������⣺��2����1���в�õ�ʵ��ֵƫ�ͣ�����ԭ���У������ȼƵı���ƿЧ�����ã����������Ҫ���ȣ�
���Դ��ǣ������ȼƵı���ƿЧ�����ã����������Ҫ���ȣ���3��HNO3��KOHΪǿ����ǿ���ϡ��Һ�����кͷ�Ӧ����ЧӦ��H+��aq��ʮOH����aq��=H2O��H3=��57.3kJ/mol��ϡH2SO4��Ba��OH��2��aq���γɳ������ų��������ų�����������57.3kJ�����H1����57.3kJ/mol��Ũ��������ˮʱ�ų�����������������Զ����57.3kJ����H2����57.3kJ/mol�����ԡ�H2����H1����H3��
���Դ��ǣ���H2����H1����H3 ��

����Ŀ����ΪԪ�����ڱ���һ���֣����еı�Ŵ�������Ӧ��Ԫ�أ���ش��������⣺ 
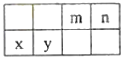
��1�����Ԫ�صĻ�̬ԭ�ӵļ۵����Ų�ʽ�� �� ����ͬ���ڣ��һ�̬ԭ�ӵĺ���δ�ɶԵ���������Ԫ������д��Ԫ�ط��ţ���
��2���ܺ���ߺ�Ԫ���γɵ���������۵��ɸߵ��͵��� ��
��3���ٺ���ۺ�Ԫ���γɵĺ���18���ӵķ���Ϊ��д�����ƣ����÷����Тۺ�Ԫ�ص�ԭ�ӵ��ӻ���ʽΪ �� �ڡ��ܡ�������Ԫ�ص�ԭ���γɵľ��壬�侧���Ľṹ�ص���ͼ��ʾ����û�����Ļ�ѧʽΪ���ö�Ӧ��Ԫ�ط��ű�ʾ���� 
��4���±���ijЩ������Ԫ�صĵ縺��ֵ��
Ԫ�ط��� | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
�縺�� | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.1 |
��ͨ�������縺��ֵ�仯���ɣ�ȷ��N��ӽ��ĵ縺��ֵ��Χ����N�� ��
���Ʋ�縺��ֵ��ԭ�Ӱ뾶��ϵ�� ��
�����ƶϣ�AlBr3�л�ѧ�������� ��