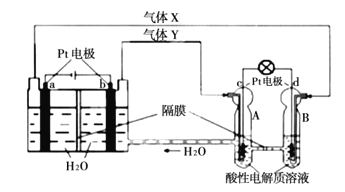
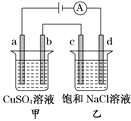
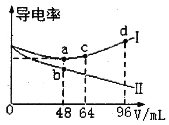
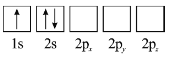
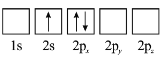
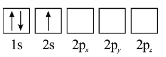
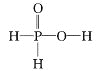
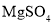题目内容
【题目】在常温下,向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,混合溶液的
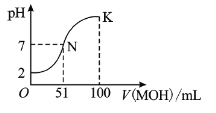
溶液,混合溶液的![]() 变化情况如图中所示曲线(体积变化忽略不计)。下列叙述正确的是( )
变化情况如图中所示曲线(体积变化忽略不计)。下列叙述正确的是( )
A.![]() 溶液的
溶液的![]() B.
B.![]() 点时加水稀释溶液,
点时加水稀释溶液,![]() 减小
减小
C.在![]() 点,
点,![]() D.在
D.在![]() 点,
点,![]()
【答案】A
【解析】
根据图象,0.01mol/LHA溶液的pH=2,c(H+)=c(HA),则HA是强酸;N点溶液MOH过量但是溶液pH=7,说明MOH是弱碱,据此分析解答。
A.MA是强酸弱碱盐,M+水解导致溶液呈酸性,溶液的pH<7,故A正确;
B.K点溶液中溶质为等物质的量浓度的MA、MOH,K点溶液加水稀释导致溶液中c(OH-)减小,温度不变,水的离子积常数不变,则c(H+)增大,故B错误;
C.N点溶液呈中性,则c(OH-)=c(H+),溶液中存在电荷守恒c(OH-)+(A-)=c(M+)+c(H+),则c(A-)=c(M+),所以c(A-)<c(M+)+c(MOH),故C错误;
D.K点溶液中溶质为等物质的量浓度的MA、MOH,溶液呈碱性,c(OH-)>c(H+),说明MOH电离程度大于M+的水解程度,但是其电离和水解程度都较小,所以存在c(M+)>c(A-)>c(OH-)>c(H+),故D错误;
故选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A. | 向 | 黄色逐渐消失,加 | 还原性: |
B. | 将金属钠在燃烧匙中点燃,迅速伸入集满 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 |
|
C. | 将足量的 | 酸性 |
|
D. | 将 | 先有白色沉淀生成,后变为蓝色沉淀 |
|
A.AB.BC.CD.D