题目内容
【题目】用如图所示装置分别进行实验,请回答下列问题:
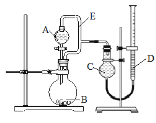
实验 | A中试剂 | B中试剂 | C中液体 |
I | 饱和食盐水 | 电石 | H2O |
II | 浓氨水 | NaOH固体 | CCl4 |
III | 生铁 | H2O | |
IV | NaOH溶液 | 镁铝合金 | H2O |
(1)导管E的作用是:____________________、_________________;
(2)实验I烧瓶B中发生反应的化学方程式是________,产生的气体经验纯后点燃,现象是___________;
(3)实验Ⅱ剩余的NH3需吸收处理。以下各种尾气吸收装置中,不能防止倒吸的是___________;

(4)实验III的实验目的是验证生铁在潮湿空气中会发生吸氧腐蚀。则A中试剂可选用__________(填序号);
a NaOH溶液 b C2H5OH c NaCl溶液 d 稀硫酸
能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是_________;
(5)写出实验IV中发生反应的离子方程式_________;若读数时C管液面低于D管液面,则测出的镁铝合金中镁的质量分数将_______(填“偏高”、“偏低”或“无影响”)。
【答案】保持锥形瓶和分液漏斗间的压强恒定,使液体能顺利滴下 消除因液体的滴入引起的体积误差 CaC2+2H2O→Ca(OH)2+ C2H2↑ 火焰明亮并伴有浓烈的黑烟 be ac C管的液面上升,D管液面下降 2Al+2H2O+2OH-→2AlO2-+3H2↑ 偏高
【解析】
(1)根据实验装置构造及压强变化分析解答;
(2)根据物质性质书写反应方程式,分析反应现象;
(3)根据倒吸原理及装置图分析解答;
(4)吸氧腐蚀原理及装置构造分析解答;
(5)根据铝的化学性质及实验现象分析解答。
(1)导管E的作用是保持恒压,使液体顺利流下,减少液体滴入对体积测定的影响,作用为:保持锥形瓶和分液漏斗间的压强恒定,使液体能顺利滴下、消除因液体的滴入引起的体积误差,故答案为:保持锥形瓶和分液漏斗间的压强恒定,使液体能顺利滴下;消除因液体的滴入引起的体积误差;
(2)实验I烧瓶B中发生反应是电石和饱和食盐水反应生成氢氧化钙和乙炔,反应的化学方程式为:CaC2+2H2O→Ca(OH)2+ C2H2↑,产生的气体经验纯后点燃,现象是火焰明亮并伴有浓烈的黑烟,故答案为:CaC2+2H2O→Ca(OH)2+ C2H2↑,火焰明亮并伴有浓烈的黑烟;
(3)a、对于极易溶于水的气体,吸收装置中的导管外联双球状导管内伸入到液体中,液体进入双球内,防止进入前端装置,能防止倒吸,故a不选;
b、吸收装置中的导管下联漏斗,漏斗口伸入液面以下,易吸收易溶性气体,不能防止倒吸;故b选;
c、对于极易溶于水的气体,吸收装置中的导管与干燥管连接,当水进入干燥管内,烧杯内液面下降低于导管口,液体又流落到烧杯中,能防止倒吸,故c不选;
d、氨气极易溶于水,不溶于四氯化碳,所以导管通入四氯化碳中,气泡向上到水层溶解,能防止倒吸,故d不选;
e、氨气极易溶于水,导管插入溶液中形成喷泉,进气管在烧瓶口,液体经进气管倒流入前端装置,产生倒吸,故e选;
f、氨气极易溶于水,导管插入溶液中形成喷泉,进气管在烧瓶底部,液体不能流入前端装置,能防止倒吸,故f不选;所以能防倒吸的吸收装置有acdf,不能防倒吸的是be;故答案为:be;
(4)钢铁在中性或弱碱性环境中易发生吸氧腐蚀,乙醇是非电解质不等形成原电池,稀硫酸溶液中氢离子在正极得到电子生成氢气,发生析氢腐蚀,故选ac,吸氧腐蚀消耗氧气,故量气管右端D中液面下降,左端C中液面上升,故答案为:ac;C管的液面上升,D管液面下降;
(5)镁铝合金在氢氧化钠溶液中,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2H2O+2OH-→2AlO2-+3H2↑ ;若读数时C管液面低于D管液面,测定氢气体积减小,铝的质量减小,镁的质量增大;测出的镁铝合金中镁的质量分数将偏高,故答案为:2Al+2H2O+2OH-→2AlO2-+3H2↑;偏高。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】滴定法不仅适合于酸碱中和滴定,还可以用于氧化还原滴定和沉淀滴定。
I. 甲同学根据反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,进行测定H2C2O4溶液的物质的量浓度的实验。实验步骤如下:
①取待测H2C2O4溶液25.00 mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1 mol/L KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00 mL。请回答:
(1)滴定时,将KMnO4溶液装在 __________(填“酸式”或“碱式”)滴定管中。
(2)滴定过程中眼睛注视 __________。
(3)计算H2C2O4溶液的物质的量浓度为 ________mol/L。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 _________(填字母代))。
A 滴定终点读数时俯视 B 取用待测液的滴定管水洗后未用待测液润洗
C 锥形瓶水洗后未干燥 D 装标准液的滴定管尖嘴部分有气泡,滴定后消失
II. 已知:
AgCl | AgBr | AgSCN | Ag2CrO4 | AgCN | |
溶解度(mol/L) | 1.34×10-6 | 7.1×10-7 | 1.0×10-6 | 6.5×10-5 | 1.1×10-8 |
颜色 | 白 | 淡黄 | 白 | 砖红 | 白 |
(5)①乙同学参照上表已知信息用硝酸银标准溶液滴定氯离子含量时可以作指示剂的是_______(填字母代号)。
a CaCl2 b NaBr c NaCN d K2CrO4
②滴定达终点的现象是___________。
【题目】能源、材料已成为当今科学研究的热点。请回答下列问题:
(1)单质A的燃烧热大,可作燃料。已知A为短周期元素,其气态原子逐个失去1~4个电子所需能量(电离能)如表所示。若该原子核外电子有三层,则该元素位于周期表______族,写出A燃烧后形成的氧化物的电子式:______.
I1 | I2 | I3 | I4 | … | |
电离能(kJ/mol) | 738 | 1451 | 7733 | 10540 | … |
(2)如图是超导材料元素在周期表中的分布,上述元素的短周期元素中原子半径最大的是______(填元素符号),其原子最外层有______种运动状态不同的电子,写出其最高价氧化物对应水化物在水溶液中的电离方程式:______。
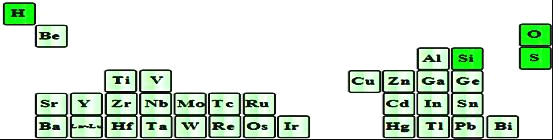
(3)上述主族元素中有两种原子可以形成的五核分子,其化学键键长和键角都相等,则该分子的空间构型为______,该物质为______分子(选填“极性”或“非极性”)。
(4)铁单质在高温下会与水蒸气反应生成一种黑色固体和一种易燃性气体,且每生成1mol该易燃气体放出37.68kJ热量,请写出此反应的热化学方程式:______。
(5)取适量Al、Mg合金样品置于烧杯中,加入20mL 1mol/L的NaOH溶液,恰好完全反应。下列叙述正确的是______(选填编号)。
a.Mg作负极,Al作正极
b.若加入的是20mL 1mol/L的盐酸,则放出的氢气的物质的量减少2/3
c.若把NaOH中的H换成D(D为重氢),生成的氢气中D与H物质的量之比为1:2。