题目内容
【题目】下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
A.实验室中配制FeCl3溶液时,应向其中加入少量浓盐酸
B.合成氨工业中使用铁触媒做催化剂
C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体
D.热的纯碱溶液去油污效果好
【答案】B
【解析】
A、FeCl3中Fe3+会水解,Fe3++3H2O![]() Fe(OH)3+3H+,加入盐酸抑制Fe3+的水解,符合勒夏特列原理,A不符合题意;
Fe(OH)3+3H+,加入盐酸抑制Fe3+的水解,符合勒夏特列原理,A不符合题意;
B、N2+3H2![]() 2NH3,催化剂对化学平衡无影响,不符合勒夏特列原理,B符合题意;
2NH3,催化剂对化学平衡无影响,不符合勒夏特列原理,B符合题意;
C、FeCl3中Fe3+会水解,Fe3++3H2O![]() Fe(OH)3+3H+,水解是吸热反应,加热向正反应方向进行,符合勒夏特列原理,C不符合题意;
Fe(OH)3+3H+,水解是吸热反应,加热向正反应方向进行,符合勒夏特列原理,C不符合题意;
D、CO32-+H2O![]() HCO3-+OH-,属于吸热反应,加热促进水解,碱性增强,油脂在碱性环境下水解,去污效果好,符合勒夏特列原理,D不符合题意。
HCO3-+OH-,属于吸热反应,加热促进水解,碱性增强,油脂在碱性环境下水解,去污效果好,符合勒夏特列原理,D不符合题意。
答案选B。

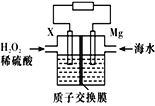
【题目】如图所示,某化学兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:

(1)通入氧气的电极为_____(填“正极”或“负极”),通氢气一极的电极反应式为_________________;
(2)铁电极为_______(填“阳极”或“阴极”),乙装置中电解反应的化学方程式为_________________。
(3)若在标准状况下,有1.12 L氧气参加反应,丙装置中阴极增重的质量为______g;
(4)某粗铜中含有铁、金、银和铂等杂质,通过电解精制后,为从电解液中制得硫酸铜晶体(CuSO4·5H2O),设计了如下工艺流程:

已知:几种金属阳离子开始沉淀和沉淀完全的pH:
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ | 1.9 | 3.2 |
Fe2+ | 7.0 | 9.0 |
Cu2+ | 4.7 | 6.7 |
①步骤I中加入试剂A的目的是_____________________________,试剂A应选择______(填序号);
a.氯气 b.过氧化氢 C.酸性高锰酸钾溶液
选择该试剂的原因_____________________________________________________;
②步骤II中试剂B为_________,调节pH的范围是___________;
③步骤III的操作是加热浓缩、_______、___________。
【题目】滴定法不仅适合于酸碱中和滴定,还可以用于氧化还原滴定和沉淀滴定。
I. 甲同学根据反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,进行测定H2C2O4溶液的物质的量浓度的实验。实验步骤如下:
①取待测H2C2O4溶液25.00 mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1 mol/L KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00 mL。请回答:
(1)滴定时,将KMnO4溶液装在 __________(填“酸式”或“碱式”)滴定管中。
(2)滴定过程中眼睛注视 __________。
(3)计算H2C2O4溶液的物质的量浓度为 ________mol/L。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 _________(填字母代))。
A 滴定终点读数时俯视 B 取用待测液的滴定管水洗后未用待测液润洗
C 锥形瓶水洗后未干燥 D 装标准液的滴定管尖嘴部分有气泡,滴定后消失
II. 已知:
AgCl | AgBr | AgSCN | Ag2CrO4 | AgCN | |
溶解度(mol/L) | 1.34×10-6 | 7.1×10-7 | 1.0×10-6 | 6.5×10-5 | 1.1×10-8 |
颜色 | 白 | 淡黄 | 白 | 砖红 | 白 |
(5)①乙同学参照上表已知信息用硝酸银标准溶液滴定氯离子含量时可以作指示剂的是_______(填字母代号)。
a CaCl2 b NaBr c NaCN d K2CrO4
②滴定达终点的现象是___________。
【题目】碳酸氢纳俗称“小苏打”,是氨碱法和联合制碱法制纯碱的中间产物,可用作膨松剂,制酸剂,灭火剂等。工业上用纯碱溶液碳酸化制取碳酸氢钠。
(1)某碳酸氢钠样品中含有少量氯化钠。称取该样品,用0.1000mol/L盐酸滴定,耗用盐酸20.00mL。若改用0.05618mol/L硫酸滴定,需用硫酸____________mL(保留两位小数)。
(2)某溶液组成如表一:
化合物 | Na2CO3 | NaHCO3 | NaCl |
质量(kg) | 814.8 | 400.3 | 97.3 |
问该溶液通入二氧化碳,析出碳酸氢钠晶体。取出晶体后溶液组成如表二:
化合物 | Na2CO3 | NaHCO3 | NaCl |
质量(kg) | 137.7 | 428.8 | 97.3 |
计算析出的碳酸氢钠晶体的质量(保留1位小数)。____________
(3)将组成如表二的溶液加热,使碳酸氢钠部分分解,溶液中NaHCO3的质量由428.8kg降为400.3kg,补加适量碳酸钠,使溶液组成回到表一状态。计算补加的碳酸钠质量(保留1位小数)。____________
(4)某种由碳酸钠和碳酸氢钠组成的晶体452kg溶于水,然后通入二氧化碳,吸收二氧化碳44.8×103L(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠504kg。通过计算确定该晶体的化学式____________