题目内容
【题目】在恒温恒容的密闭容器中按照下表甲、乙、丙三种方式分别投料,发生反应:3H2(g)+N2(g) ![]() 2NH3(g),测得甲容器中H2的平衡转化率为 40%,下列说法正确的是( ).
2NH3(g),测得甲容器中H2的平衡转化率为 40%,下列说法正确的是( ).
N2(mol) | H2(mol) | NH3(mol) | |
甲 | 1 | 3 | 0 |
乙 | 0.5 | 1.5 | 1 |
丙 | 0 | 0 | 4 |
A.乙容器中反应向逆向进行
B.达到平衡时,甲、乙、丙三容器中NH3体积分数的大小顺序:甲=乙>丙
C.乙中的NH3转化率为40%
D.若丙在恒温恒压的密闭容器进行,平衡后往容器中再充入4 mol NH3,重新达到平衡时,体系中NH3体积分数不变
【答案】AD
【解析】
A. 甲、乙容器是等效的,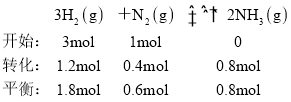 ,根据甲中氨气的量为0.8mol,则乙中反应向逆向进行,故A正确;
,根据甲中氨气的量为0.8mol,则乙中反应向逆向进行,故A正确;
B. 达到平衡时,甲、乙两个容器中NH3体积分数的大小相等:甲=乙,丙容器可以理解先变为是甲容器的两倍,则此时NH3体积分数与甲相等,但又变为与甲容器一样大,则加压,平衡正向移动,氨气体积分数变大,因此三个容器中NH3体积分数的大小相等:丙>甲=乙,故B错误;
C. 甲乙容器是等效平衡的,平衡是氨气的物质的量为0.8mol,乙则消耗0.2mol,此时乙中的NH3转化率![]() ,故C错误;
,故C错误;
D. 若丙在恒温恒压的密闭容器进行,平衡后往容器中再充入4 mol NH3,前后两者是等效平衡,重新达到平衡时,体系中NH3体积分数不变,故D正确。
综上所述,答案诶AD。

【题目】根据下列物质变化,所得能量变化关系正确的是
物质变化 | 能量关系 | |
A | 将充满NO2的针筒置于热水中,气体颜色变深 | 1molN2O4(g)的能量>2molNO2(g)的能量 |
B | 将NaOH溶液与HCl溶液混合 |
|
C | 1g气态SiH4在空气中燃烧,生成SiO2 (s)与液态水,放热44.6kJ | SiH4(g)+2O2(g)→SiO2(s)+2H2O(l)+44.6kJ |
D | 合成氨:N2(g)+3H2(g) | 反应物的总键能>生成物的总键能 |
A.AB.BC.CD.D
【题目】滴定法不仅适合于酸碱中和滴定,还可以用于氧化还原滴定和沉淀滴定。
I. 甲同学根据反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,进行测定H2C2O4溶液的物质的量浓度的实验。实验步骤如下:
①取待测H2C2O4溶液25.00 mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1 mol/L KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00 mL。请回答:
(1)滴定时,将KMnO4溶液装在 __________(填“酸式”或“碱式”)滴定管中。
(2)滴定过程中眼睛注视 __________。
(3)计算H2C2O4溶液的物质的量浓度为 ________mol/L。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 _________(填字母代))。
A 滴定终点读数时俯视 B 取用待测液的滴定管水洗后未用待测液润洗
C 锥形瓶水洗后未干燥 D 装标准液的滴定管尖嘴部分有气泡,滴定后消失
II. 已知:
AgCl | AgBr | AgSCN | Ag2CrO4 | AgCN | |
溶解度(mol/L) | 1.34×10-6 | 7.1×10-7 | 1.0×10-6 | 6.5×10-5 | 1.1×10-8 |
颜色 | 白 | 淡黄 | 白 | 砖红 | 白 |
(5)①乙同学参照上表已知信息用硝酸银标准溶液滴定氯离子含量时可以作指示剂的是_______(填字母代号)。
a CaCl2 b NaBr c NaCN d K2CrO4
②滴定达终点的现象是___________。