题目内容
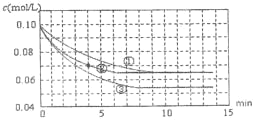
【题目】二氧化硫是造成大气污染的主要有害气体之一,工业制备硫酸的接触室中二氧化硫不能完全转化为三氧化硫,尾气必须处理。某兴趣小组模拟接触室中反应,如图是分别在三种不同实验条件下进行反应,反应物二氧化硫的浓度随时间的变化。
(1)工业制硫酸的接触室中用二氧化硫与氧气制三氧化硫的生产条件为_______。
(2)实验②,0~4min 平均反应速率v(O2)=______。
(3)实验③可能改变的条件是什么:______请简述理由。______(已知正反应放热)
(4)二氧化硫尾气可以用氨水吸收,最终的产物可能有(NH4)2SO4、(NH4)2SO3、NH4HSO3。若三者的物质的量浓度相同时,铵根离子浓度由大到小的顺序为______。
(5)浓硫酸是常见的干燥剂,请解释不能干燥硫化氢与氨气的原因_____。
【答案】常压、催化剂、加热 0.00375mol/(Lmin) 降低温度 实验③中反应达到平衡的时间增加,SO2的转化率升高 (NH4)2SO4、(NH4)2SO3、NH4HSO3 浓硫酸具有强氧化性会氧化硫化氢,具有酸性会与氨气反应
【解析】
(1)根据可逆反应的特点及化学反应速率、化学平衡移动原理分析;
(2)实验②,先计算0-4min v(SO2)平均反应速率,然后根据不同物质的速率关系,计算v(O2);
(3)根据反应特点,结合达到平衡时间、平衡时SO2的含量判断反应条件;
(4)根据盐的组成判断NH4+浓度的大小;
(5)根据氧化还原反应规律分析。
(1)SO2与O2生成SO3的反应为可逆反应,方程式为:2SO2+O2![]() 2SO3,由于升高温度、使用催化剂可加快反应速率,缩短达到平衡所需要的时间,所以反应要在催化剂、加热下进行,由于在常压下反应物SO2的转化率较大,若采用增大压强的方法,尽管增大压强,可以加快反应速率,可以使化学平衡正向移动,提高SO2的转化率,但产生大的动力消耗较大的能量,而且对设备的材料投入相应的也增大,平衡移动SO2的转化率增大不多,不经济,因此一般就采用常压条件下,加热和使用催化剂进行反应;
2SO3,由于升高温度、使用催化剂可加快反应速率,缩短达到平衡所需要的时间,所以反应要在催化剂、加热下进行,由于在常压下反应物SO2的转化率较大,若采用增大压强的方法,尽管增大压强,可以加快反应速率,可以使化学平衡正向移动,提高SO2的转化率,但产生大的动力消耗较大的能量,而且对设备的材料投入相应的也增大,平衡移动SO2的转化率增大不多,不经济,因此一般就采用常压条件下,加热和使用催化剂进行反应;
(2)对于实验②,根据图示可知在0~4min 内平均反应速率v(SO2)=![]() =0.0075 mol/(Lmin),由于用不同物质表示反应速率时,速率比等于化学计量数的比,所以v(O2)=
=0.0075 mol/(Lmin),由于用不同物质表示反应速率时,速率比等于化学计量数的比,所以v(O2)=![]() v(SO2)=
v(SO2)=![]() ×0.0075 mol/(Lmin)=0.00375mol/(Lmin);
×0.0075 mol/(Lmin)=0.00375mol/(Lmin);
(3)根据图象可知:实验③达到平衡所需时间长,说明反应速率减小,而且达到平衡时SO2的浓度降低,平衡含量降低,说明化学平衡正向移动,由于可逆反应2SO2+O2![]() 2SO3的正反应是气体体积减小的放热反应,则改变的条件是降低反应温度;
2SO3的正反应是气体体积减小的放热反应,则改变的条件是降低反应温度;
(4)若产生的三种盐(NH4)2SO4、(NH4)2SO3、NH4HSO3的物质的量浓度相同,根据电离方程式(NH4)2SO4=2NH4++SO42-、(NH4)2SO3=2NH4++SO32-、NH4HSO3=NH4++HSO3-,可知铵根离子浓度最小的是NH4HSO3;(NH4)2SO4是强酸弱碱盐,只存在NH4+的水解作用,而(NH4)2SO3是弱酸弱碱盐,在溶液中NH4+、SO32-都发生水解反应,SO32-水解反应对NH4+的水解起促进作用,导致NH4+的浓度比(NH4)2SO4的小,所以若三者的物质的量浓度相同时,铵根离子浓度由大到小的顺序为(NH4)2SO4、(NH4)2SO3、NH4HSO3;
(5)浓硫酸是常见的干燥剂,浓硫酸中+6价的S具有强的氧化性,因而使具有强氧化性,而H2S具有还原性,二者会发生氧化还原反应产生S和H2O,因此不能干燥硫化氢;浓硫酸具有酸性,会与碱性气体氨气反应产生硫酸铵,因此也不能用硫酸干燥氨气。

 世纪百通主体课堂小学课时同步达标系列答案
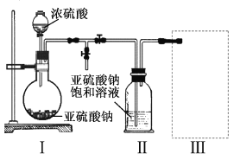
世纪百通主体课堂小学课时同步达标系列答案【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )

选项 | 气体 | a | b | c | d |
A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO溶液 | 浓硫酸 |
B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
A. A B. B C. C D. D