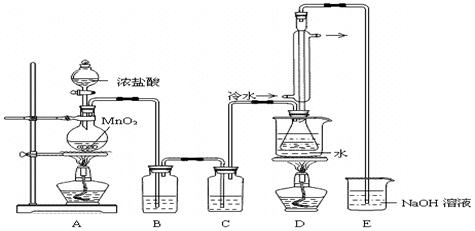
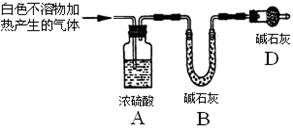
题目内容
有编号为A、B、C、D的四瓶无色液体,仅知道是1%酚酞、0.1mol·L-1NaOH溶液、0.1mol·L-1盐酸和0.1mol·L-1NaCl溶液。化学老师现要求甲、乙、丙、丁四位学生对它们进行鉴别,规定每人只需鉴别两瓶溶液,如果两瓶溶液鉴别都正确,得满分,如果只有一瓶鉴别正确,则算及格。以下是四位学生的鉴别结果:
下列结论正确的是
A.A为1%酚酞 B.B为0.1mol·L-1NaCl溶液
C.C为0.1mol·L-1NaOH溶液 D.D为0.1mol·L-1盐酸
| A | A为0.1mol·L -1盐酸 | D为0.lmol·L-1NaCl溶液 | 老师评价:四位学生都及格,但是没有一个得满分 |
| B | A为0.1mol·L -1NaOH溶液 | C为0.1mol·L-1盐酸 | |
| C | A为1%酚酞 | B为0.1mol·L-1盐酸 | |
| D | D为0.1mol·L-1盐酸 | B为0.1mol·L-1 NaOH溶液 |
下列结论正确的是
A.A为1%酚酞 B.B为0.1mol·L-1NaCl溶液
C.C为0.1mol·L-1NaOH溶液 D.D为0.1mol·L-1盐酸
A
试题分析:结合题意每项均只有一个结论正确,假设若A项A为0.1mol·L -1盐酸,则D不是0.lmol·L-1NaCl溶液,B项A为0.1mol·L -1NaOH溶液,C为0.1mol·L-1盐酸均错误,所以A项A不为0.1mol·L -1盐酸,而D是0.lmol·L-1NaCl溶液,结合D项知B为0.1mol·L-1 NaOH溶液,所以C项中B为0.1mol·L-1盐酸错误,因此A为1%酚酞正确,故选择A。

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目



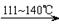 CCl4+S2Cl2;② 2S+Cl2
CCl4+S2Cl2;② 2S+Cl2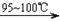 S2Cl2。
S2Cl2。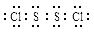 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下: