题目内容
已知在25℃时:
①2C(石墨)+O2(g)=2CO(g) △H1=-222kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H2=-484kJ/mol
③C(石墨)+O2(g)=CO2 △H3=-394kJ/mol
则25℃时,CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H4为:
①2C(石墨)+O2(g)=2CO(g) △H1=-222kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H2=-484kJ/mol
③C(石墨)+O2(g)=CO2 △H3=-394kJ/mol
则25℃时,CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H4为:
| A.-82kJ/mol | B.-41kJ/mol | C.-312kJ/mol | D.+41kJ/mol |
B
试题分析:应用题干热化学方程式,利用盖斯定律,通过系数或方向进行合并计算得到所求的热化学方程式得到反应的焓变;依据盖斯定律③—①×1/2—②×1/2得CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H4=△H3—1/2△H2—1/2△H1=-41kJ/mol,选B。

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1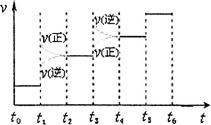
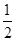 H2(g)+
H2(g)+  2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
 FeO(s) +CO(g) ΔH ="a" kJ/mol
FeO(s) +CO(g) ΔH ="a" kJ/mol 
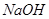 溶液喷淋“捕捉”空气中的
溶液喷淋“捕捉”空气中的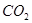 。
。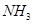 为原料可合成化肥尿素[
为原料可合成化肥尿素[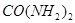 ]。已知:
]。已知:
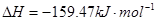 ①
①
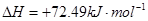 ②
②
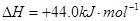 ③
③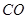 ,在催化剂作用下CO和
,在催化剂作用下CO和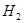 反应生成甲醇:
反应生成甲醇: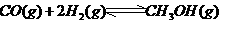 某容积可变的密闭容器中充有10molCO与20mol
某容积可变的密闭容器中充有10molCO与20mol
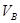 _______VL。(填“大于”、“小于”或“等于”)
_______VL。(填“大于”、“小于”或“等于”)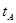 _______
_______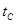 (填“>”、“<”或“=”)
(填“>”、“<”或“=”) O2(g) = H2O(g) △H1
O2(g) = H2O(g) △H1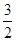 H2(g) = NH3 (g) △H3
H2(g) = NH3 (g) △H3 O2(g) =2NO2 (g) +3H2O(g) 的△H=
O2(g) =2NO2 (g) +3H2O(g) 的△H=

 CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-1 CH3CH2OH(g)+3H2O(l) △H= 。
CH3CH2OH(g)+3H2O(l) △H= 。
