题目内容
“节能减排”,减少全球温室气体排放,意义十分重大。二氧化碳的捕捉与封存是实现温室气体减排的重要途径之一,科学家利用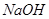 溶液喷淋“捕捉”空气中的
溶液喷淋“捕捉”空气中的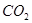 。
。
(1)使用过量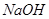 溶液吸收
溶液吸收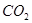 ,反应的离子方程式为________;若含有3molNaOH的溶液“捕捉”了22.4L
,反应的离子方程式为________;若含有3molNaOH的溶液“捕捉”了22.4L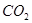 气体(标准状况),则所得溶液中钠与碳元素的物料守恒关系式为__________(用离子浓度的关系式表示)。
气体(标准状况),则所得溶液中钠与碳元素的物料守恒关系式为__________(用离子浓度的关系式表示)。
(2)①以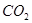 和
和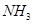 为原料可合成化肥尿素[
为原料可合成化肥尿素[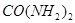 ]。已知:
]。已知:

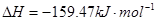 ①
①

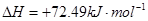 ②
②

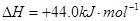 ③
③
试写出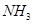 和
和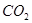 合成尿素和液态水的热化学方程式__________。
合成尿素和液态水的热化学方程式__________。
②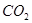 通过反应可转化为
通过反应可转化为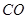 ,在催化剂作用下CO和
,在催化剂作用下CO和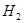 反应生成甲醇:
反应生成甲醇: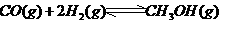 某容积可变的密闭容器中充有10molCO与20mol
某容积可变的密闭容器中充有10molCO与20mol ,CO的平衡转化率(a)与温度、压强的关系如下图所示。
,CO的平衡转化率(a)与温度、压强的关系如下图所示。
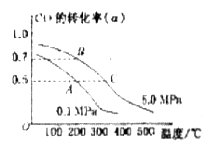
A.若A点表示在某时刻达到的平衡状态,此时容器的容积为VL,则该温度下的平衡常数K=__________;平衡状态B点时容器的容积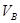 _______VL。(填“大于”、“小于”或“等于”)
_______VL。(填“大于”、“小于”或“等于”)
B.若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间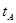 _______
_______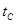 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
C.在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是________(写出一种即可)。
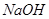 溶液喷淋“捕捉”空气中的
溶液喷淋“捕捉”空气中的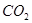 。
。(1)使用过量
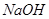 溶液吸收
溶液吸收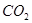 ,反应的离子方程式为________;若含有3molNaOH的溶液“捕捉”了22.4L
,反应的离子方程式为________;若含有3molNaOH的溶液“捕捉”了22.4L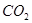 气体(标准状况),则所得溶液中钠与碳元素的物料守恒关系式为__________(用离子浓度的关系式表示)。
气体(标准状况),则所得溶液中钠与碳元素的物料守恒关系式为__________(用离子浓度的关系式表示)。(2)①以
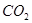 和
和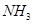 为原料可合成化肥尿素[
为原料可合成化肥尿素[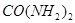 ]。已知:
]。已知:
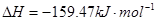 ①
①
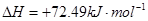 ②
②
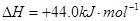 ③
③试写出
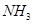 和
和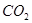 合成尿素和液态水的热化学方程式__________。
合成尿素和液态水的热化学方程式__________。②
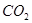 通过反应可转化为
通过反应可转化为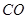 ,在催化剂作用下CO和
,在催化剂作用下CO和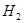 反应生成甲醇:
反应生成甲醇: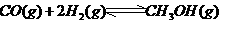 某容积可变的密闭容器中充有10molCO与20mol
某容积可变的密闭容器中充有10molCO与20mol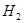 ,CO的平衡转化率(a)与温度、压强的关系如下图所示。
,CO的平衡转化率(a)与温度、压强的关系如下图所示。
A.若A点表示在某时刻达到的平衡状态,此时容器的容积为VL,则该温度下的平衡常数K=__________;平衡状态B点时容器的容积
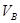 _______VL。(填“大于”、“小于”或“等于”)
_______VL。(填“大于”、“小于”或“等于”)B.若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间
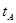 _______
_______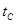 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)C.在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是________(写出一种即可)。
(1)CO2 + OH-=HCO3- c(Na+)=3[c(CO32—)+ c(HCO3—)+c(H2CO3)]
(2)①2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) △H=—130.98KJ/mol;②a、0.01v2(mol.L-1)2 小于
b、> c、加压、降温或分离出甲醇
(2)①2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) △H=—130.98KJ/mol;②a、0.01v2(mol.L-1)2 小于
b、> c、加压、降温或分离出甲醇
试题分析:(1)使用过量NaOH溶液吸收CO2生成碳酸氢钠,反应的离子方程式为CO2 + OH-=HCO3-
3molNaOH的溶液“捕捉”了1mol CO2气体,根据质量守恒定律钠是碳的3倍,所得溶液为碳酸钠和氢氧化钠的混合物,碳酸钠水解,溶液中含碳微粒有碳酸根、碳酸氢根和碳酸分子。钠与碳元素的物料守恒关系式为c(Na+)=3[c(CO32—)+ c(HCO3—)+c(H2CO3)];(2)①根据盖斯定律:①+②—③得NH3和CO2合成尿素和液态水的热化学方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) △H=—130.98KJ/mol;②a:A点对应的α=0.5,CO(g)+2H2(g)?CH3OH(g).
起始(mol) 10 20 0
转化(mol) 5 10 5
平衡(mol) 5 10 5
则K= C(CH3OH)/ C2(H2)C(CO),容器的体积为VL,代入数据计算得K=0.01v2(mol.L-1)2;B点与A点温度相同,B点压强大于A点,所以平衡状态B点时容器的容积VB小于VL;b、C点温度高于A点,温度越高反应速率越快,达平衡的时间越短,所以若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA>tB;C.在不改变反应物用量的情况下,为提高CO的转化率,根据平衡移动原理,可采取的措施是加压、降温或分离出甲醇。

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
 CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):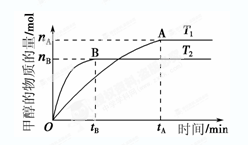
 mol·L-1·min-1
mol·L-1·min-1 增大
增大
 NCl3+3H2↑;假设NCl3中氮元素为+3价。
NCl3+3H2↑;假设NCl3中氮元素为+3价。
 H1=" +1175.7" kJ·mol-1
H1=" +1175.7" kJ·mol-1 H3=" +482.2" kJ·mol-1
H3=" +482.2" kJ·mol-1 O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2