题目内容
2013年12月2日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥三号”探月卫星成功送入太空,进一步向广寒宫探索。“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H = -543kJ·mol-1
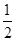 H2(g)+
H2(g)+ 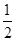 F2(g) = HF(g) △H = -269kJ·mol-1
F2(g) = HF(g) △H = -269kJ·mol-1
H2(g)+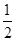 O2(g) = H2O(g) △H = -242kJ·mol-1
O2(g) = H2O(g) △H = -242kJ·mol-1
请写出肼和氟气反应的热化学方程式:_____________________________。
Ⅱ.氧化剂二氧化氮可由NO和 O2生成,已知在2 L密闭容器内,800 ℃时反应:
2NO(g)+O2(g) 2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
(1) 已知:K800℃>K1000℃,则该反应的ΔH ______0(填“大于”或“小于”),用O2表示从0~2 s内该反应的平均速率为__________。
(2)能说明该反应已达到平衡状态的是________。
a.容器内颜色保持不变 b. 2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有 。
(4)在上述条件下,计算通入2 mol NO和1 mol O2的平衡常数K=______________。
(5)在上述条件下,若开始通入的是0.2 mol NO2气体,达到化学平衡时,则NO2的转化率为 。
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H = -543kJ·mol-1
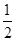 H2(g)+
H2(g)+ 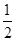 F2(g) = HF(g) △H = -269kJ·mol-1
F2(g) = HF(g) △H = -269kJ·mol-1H2(g)+
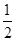 O2(g) = H2O(g) △H = -242kJ·mol-1
O2(g) = H2O(g) △H = -242kJ·mol-1请写出肼和氟气反应的热化学方程式:_____________________________。
Ⅱ.氧化剂二氧化氮可由NO和 O2生成,已知在2 L密闭容器内,800 ℃时反应:
2NO(g)+O2(g)
 2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
| n(O2)(mol) | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(1) 已知:K800℃>K1000℃,则该反应的ΔH ______0(填“大于”或“小于”),用O2表示从0~2 s内该反应的平均速率为__________。
(2)能说明该反应已达到平衡状态的是________。
a.容器内颜色保持不变 b. 2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有 。
(4)在上述条件下,计算通入2 mol NO和1 mol O2的平衡常数K=______________。
(5)在上述条件下,若开始通入的是0.2 mol NO2气体,达到化学平衡时,则NO2的转化率为 。
Ⅰ.N2H4(g)+2F2(g)=N2(g)+4HF(g) △H=-1135kJ·mol-1 (2分)
Ⅱ.(1) 小于(2分) 0.015 mol·L-1·s-1 (2分)
(2) a 、c (2分) (3)通入氧气、增大压强(2分)
(4)720 (2分) (5)25%(2分)
Ⅱ.(1) 小于(2分) 0.015 mol·L-1·s-1 (2分)
(2) a 、c (2分) (3)通入氧气、增大压强(2分)
(4)720 (2分) (5)25%(2分)
试题分析:Ⅰ.由N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-543kJ?mol-1①
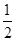 H2(g)+
H2(g)+ 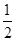 F2(g) = HF(g) △H = -269kJ·mol-1②
F2(g) = HF(g) △H = -269kJ·mol-1②H2(g)+
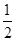 O2(g) = H2O(g) △H = -242kJ·mol-1③
O2(g) = H2O(g) △H = -242kJ·mol-1③利用盖斯定律可知①+②×4-③×2可得反应N2H4(g)+2F2(g)=N2(g)+4HF(g),
该反应的△H=(-543kJ?mol-1)+4×(-269kJ?mol-1)-2×(-242kJ?mol-1)=-1135kJ?mol-1,
故答案为:N2H4(g)+2F2(g)=N2(g)+4HF(g)△H=-1135kJ?mol-1
Ⅱ.(1) 化学平衡常数,是指在一定温度下,可逆反应都达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;K800℃>K1000℃,说明升高温度平衡向逆反应移动,故正反应是放热反应;v(O2)=(0.100-0.040)mol/2L×2 s=0.015 mol·L-1·s-1
(2)a.容器内颜色保持不变 ,说明二氧化氮的浓度保持一个定值,反应达到平衡状态,正确;
B.2v逆(NO)=v正(O2),v(NO)与v(O2)的速率比不等于方程式前面的系数,不能判断是否达到平衡,错误.
c.反应是气体压强减小的反应,平衡状态容器内压强保持不变,说明反应达到平衡,正确;
d.由于气体的质量不变,气体的体积不变,则无论是否达到平衡状态,都存在气体的密度保持不变的特征,不能判断是否达到平衡,错误。
(3)根据外界条件对反应速率与平衡的移动分析解答。
(4)平衡常数K,只和温度有关,所以通入2 mol NO和1 mol O2的平衡常数K和表格中的平衡常数相同。
2NO(g) + O2(g)
 2NO2(g)
2NO2(g) 初始(mol) 0.200 0.100 0
变化(mol) 0.150 0.075 0.150
平衡(mol) 0.050 0.025 0.150
浓度(mol/L) 0.025 0.0125 0.0750
K=
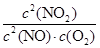 =
=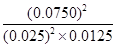 =720
=720(5)在上述条件下,若开始通入的是0.2molNO2气体,和开始通入0.200molNO和0.100molO2等效,所以达到平衡状态时NO2浓度是0.0750mol/L,初始浓度是0.100mol/L,所以反应了0.0250mol/L,即NO2转化率是25%。

练习册系列答案
相关题目

 O2(g)=H2 O(g) △H=-241.8kJ·mol-1
O2(g)=H2 O(g) △H=-241.8kJ·mol-1 2NO(g) △H
2NO(g) △H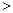 0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在1.0 L密闭容器内经过5s反应达到平衡,测得NO为8.0×10-4 mol。
0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在1.0 L密闭容器内经过5s反应达到平衡,测得NO为8.0×10-4 mol。 2CO2(g)+N2(g) 中,NO的浓度
2CO2(g)+N2(g) 中,NO的浓度

 NCl3+3H2↑;假设NCl3中氮元素为+3价。
NCl3+3H2↑;假设NCl3中氮元素为+3价。
 CH3OCH3(g) + CO2(g),ΔH=-247kJ/mol
CH3OCH3(g) + CO2(g),ΔH=-247kJ/mol C(s)=
C(s)=