题目内容
能源的开发、利用与人类社会的可持续发展息息相关,充分利用好能源是摆在人类面前的重大课题。
Ⅰ.已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=a kJ·mol-1
②CO(g)+l/2O2(g)=CO2(g) ΔH=b kJ·mol-1
③C(石墨)+O2(g)=CO2(g) ΔH=c kJ·mol-1
则反应4Fe(s)+3O2(g)=2Fe2O3(s)的焓变ΔH= kJ·mol-1。
Ⅱ.依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是 (填序号)。
A.C(s)+CO2(g)=2CO(g) ΔH>0 B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0
C.2H2O(l)=2H2(g)+O2(g) ΔH>0 D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH<0
若以稀硫酸为电解质溶液,则该原电池的正极反应式为 。
Ⅲ.氢气作为一种绿色能源,对于人类的生存与发展具有十分重要的意义。
(1)实验测得,在通常情况下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧的热化学方程式为 。
(2)用氢气合成氨的热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
①一定条件下,下列叙述可以说明该反应已达平衡状态的是 。
A.υ正(N2)=υ逆(NH3)
B.各物质的物质的量相等
C.混合气体的物质的量不再变化
D.混合气体的密度不再变化
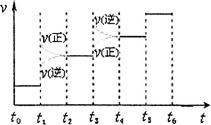
②下图表示合成氨反应达到平衡后,每次只改变温度、压强、催化剂中的某一条件,反应速率υ与时间t的关系。其中表示平衡混合物中的NH3的含量最高的一段时间是 。图中t3时改变的条件可能是 。
③温度为T℃时,将4a mol H2和2a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%,则反应的平衡常数为 。
Ⅰ.已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=a kJ·mol-1
②CO(g)+l/2O2(g)=CO2(g) ΔH=b kJ·mol-1
③C(石墨)+O2(g)=CO2(g) ΔH=c kJ·mol-1
则反应4Fe(s)+3O2(g)=2Fe2O3(s)的焓变ΔH= kJ·mol-1。
Ⅱ.依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是 (填序号)。
A.C(s)+CO2(g)=2CO(g) ΔH>0 B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0
C.2H2O(l)=2H2(g)+O2(g) ΔH>0 D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH<0
若以稀硫酸为电解质溶液,则该原电池的正极反应式为 。
Ⅲ.氢气作为一种绿色能源,对于人类的生存与发展具有十分重要的意义。
(1)实验测得,在通常情况下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧的热化学方程式为 。
(2)用氢气合成氨的热化学方程式为N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1①一定条件下,下列叙述可以说明该反应已达平衡状态的是 。
A.υ正(N2)=υ逆(NH3)
B.各物质的物质的量相等
C.混合气体的物质的量不再变化
D.混合气体的密度不再变化
②下图表示合成氨反应达到平衡后,每次只改变温度、压强、催化剂中的某一条件,反应速率υ与时间t的关系。其中表示平衡混合物中的NH3的含量最高的一段时间是 。图中t3时改变的条件可能是 。

③温度为T℃时,将4a mol H2和2a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%,则反应的平衡常数为 。
Ⅰ. 6c-6b-2a Ⅱ. D O2+4H++4e-=2H2O
Ⅲ.(1)2H2(g) +O2(g) = 2H2O(l) △H=-571.6kJ/mol (2)① C ②t2~t3 升高温度 ③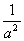 (mol/L)-2
(mol/L)-2
Ⅲ.(1)2H2(g) +O2(g) = 2H2O(l) △H=-571.6kJ/mol (2)① C ②t2~t3 升高温度 ③
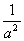 (mol/L)-2
(mol/L)-2试题分析:Ⅰ(②+③)×6-①×2得反应4Fe(s)+3O2(g)=2Fe2O3(s)的焓变ΔH=(6c-6b-2a )kJ/mol. Ⅱ.若能共存原电池,则反应必须为氧化还原反应,且为放热反应。只有D符合条件。若以稀硫酸为电解质溶液,则该原电池的正极反应式为O2+4H++4e-=2H2O。负极的电极式为CH4-8e-+2H2O= CO2+8H+。Ⅲ.(1)H2燃烧的热化学方程式为2H2(g) +O2(g) = 2H2O(l) △H=-571.6kJ/mol;(2)①A.在任何时刻υ正(N2):υ正(NH3)=1:2,υ正(NH3)=2υ正(N2),若υ正(N2)=υ逆(NH3),则υ正(NH3)=2υ逆(NH3),反应未达到平衡。错误。B. 各物质的物质的量相等,此时仅是反应的一个极特殊的情况,可能达到平衡,也可能为达到平衡。错误。C. 若混合气体的物质的量不再变化,说明任何物质的消耗的浓度与产生的浓度不变,反应达到平衡。正确。D.若容器的容积不变,任何时刻混合气体的密度不再变化,不能说明反应达到平衡。若容器为恒压条件,混合气体的密度不再变化,说明反应达到平衡。反应条件不清楚,故不能说明反应是否达到平衡。错误。②从t0—t1反应平衡,在t1时刻增大压强,V正、V逆都增大,V正增大得多,平衡正向移动,到t2时刻达到新的平衡状态;在t2—t3保持该平衡;在t3时刻升高温度,V正、V逆都增大,V逆增大得多,平衡逆向移动,达到t4时刻达到另一个新的平衡状态,在t4—t5保持该平衡;在t5时刻加入催化剂,V正、V逆都增大,二者增大的相同,平衡没有发生移动。所以表示平衡混合物中的NH3的含量最高的一段时间是t2—t3。图中t3时改变的条件是升高温度。③在反应开始是n(H2)=4amol,n(N2)=2amol,由于平衡时N2的转化率为50%,所以此时n(N2)="1amol" ; n(H2)=amol,n(NH3)="2amol." 反应的平衡常数为

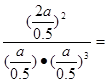
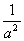 (mol/L)-2.
(mol/L)-2.
练习册系列答案
相关题目
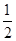 O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1
O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1

 4NO(g) △H=+292.3kJ·mol—1,
4NO(g) △H=+292.3kJ·mol—1,

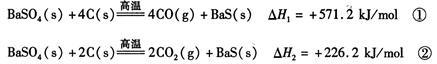
 2CO(g)的△H = kJ/mol
2CO(g)的△H = kJ/mol = 。[已知:
= 。[已知: CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):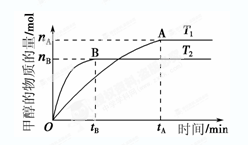
 mol·L-1·min-1
mol·L-1·min-1 增大
增大 O2(g)=H2 O(g) △H=-241.8kJ·mol-1
O2(g)=H2 O(g) △H=-241.8kJ·mol-1 2NO(g) △H
2NO(g) △H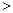 0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在1.0 L密闭容器内经过5s反应达到平衡,测得NO为8.0×10-4 mol。
0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在1.0 L密闭容器内经过5s反应达到平衡,测得NO为8.0×10-4 mol。 2CO2(g)+N2(g) 中,NO的浓度
2CO2(g)+N2(g) 中,NO的浓度