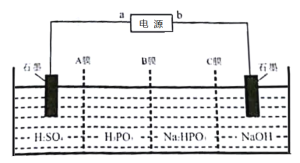
题目内容
【题目】已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F除最外层原子轨道处于半充满状态,其余能层均充满电子。请回答下列问题:
(1)B原子最高能级有___个单电子。D原子的价电子排布图为___。
(2)B与C形成的四原子阴离子,其中心原子的杂化方式为__。
(3)C3分子的立体构型为__;与其互为等电子体的分子有__,离子有__。
(4)A、B、C、D四种元素简单氢化物沸点由高到低的顺序是___。(用化学式表示)
(5)F在元素周期表中位于__区,F的晶体中原子的堆积方式是图中的__(填写“甲、乙或丙”),其配位数为__。

(6)F(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式___。
(7)CaTiO3的晶胞为立方晶胞,结构如图丁所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角)晶体的密度为ρg/cm3,Ca2+位于O2-构成的正八面体的体心位置,则该正八面体的边长为___nm(填计算式)。(CaTiO3的摩尔质量为136g/mol,NA为阿伏加德罗常数)。
【答案】3 ![]() sp2 V形 SO2 NO
sp2 V形 SO2 NO![]() H2O>HF>NH3>CH4 ds 丙 12 Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O或Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
H2O>HF>NH3>CH4 ds 丙 12 Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O或Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- 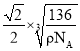 ×107
×107
【解析】
元素A、B、C、D、E、F均属前四周期,且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同,则其原子核外电子排布为1s22s22p2,故A为碳元素;C的基态原子2p轨道有2个未成对电子,原子序数大于A,故其核外电子排布为1s22s22p4,则C为氧元素,B的原子序数介于碳、氧之间,则B为氮元素;C与D形成的化合物中C显正化合价,则D的电负性大于C,所以D是F元素;E的M层电子数是N层电子数的4倍,处于第四周期,F原子序数大于E,也处于第四周期,其内部各能层均排满,且最外层电子数为1,则F的核外电子数=2+8+18+1=29,故F为Cu;结合原子序数可知,E原子最外层电子数只能为2,M层电子数是8,则E是Ca元素,据此分析解答。
(1)B为氮元素,B原子最高能级2p有3个单电子。D是F元素,D原子的价电子排布图为![]() 。故答案为:3;
。故答案为:3;![]() ;
;
(2)B与C形成的四原子阴离子为![]() ,
,![]() 离子中N原子价层电子对数=3+
离子中N原子价层电子对数=3+![]() =3,且N原子不含孤电子对,所以其空间构型为平面三角形,N原子采用sp2杂化。故答案为:sp2;
=3,且N原子不含孤电子对,所以其空间构型为平面三角形,N原子采用sp2杂化。故答案为:sp2;
(3)C为氧元素,O3分子中心原子价层电子对数=2+![]() =3,且O原子含1个孤电子对,所以其空间构型为V形,O3分子的立体构型为V形;用同族替换法和电子电荷迁移法得:与其互为等电子体的分子有SO2,离子有NO
=3,且O原子含1个孤电子对,所以其空间构型为V形,O3分子的立体构型为V形;用同族替换法和电子电荷迁移法得:与其互为等电子体的分子有SO2,离子有NO![]() 。故答案为:V形;SO2;NO
。故答案为:V形;SO2;NO![]() ;
;
(4)A、B、C、D四种元素简单氢化物中水在常温下是液态,其余为气态,HF相对分子质量大、极性强,沸点高于氨,甲烷分子间不能形成氢键,沸点最低,沸点由高到低的顺序是H2O>HF>NH3>CH4。(用化学式表示)故答案为:H2O>HF>NH3>CH4;
(5)Cu在元素周期表中位于ds区,Cu的晶体中原子的堆积方式 面心立方最密堆积,是图中的丙(填写“甲、乙或丙”),铜原子周围有上面3个,下面3个,中间层6个,其配位数为12。故答案为:ds;丙;12;

(6)Cu(OH)
(7)依据晶胞结构可知,1个晶胞含有Ca2+个数为:1,含有Ti4+个数为:![]() ×8=1,含有O2-个数为:
×8=1,含有O2-个数为:![]() ×6=3,1个晶胞含有1个CaTiO3,已知CaTiO3的摩尔质量为136g/mol,NA为阿伏加德罗常数,则1mol晶胞质量为136g,设晶胞边长为acm,则1mol晶胞体积为a3NAcm3,晶胞密度ρ=
×6=3,1个晶胞含有1个CaTiO3,已知CaTiO3的摩尔质量为136g/mol,NA为阿伏加德罗常数,则1mol晶胞质量为136g,设晶胞边长为acm,则1mol晶胞体积为a3NAcm3,晶胞密度ρ=![]() ,则a=
,则a=![]() cm,面对角线长度为:
cm,面对角线长度为:![]() acm,该正八面体的边长为
acm,该正八面体的边长为![]() cm,即
cm,即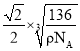 ×107nm。故答案为:
×107nm。故答案为: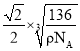 ×107。
×107。

 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案【题目】有甲、乙、丙三个体积均为2L的恒容密闭容器,按不同投料比Z[![]() 进行反应: 4HCl(g)+O2(g)
进行反应: 4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
容器 | 起始时 | 平衡时HCl转化率 | |||
n(HCl)/mol | Z | T=100℃ | T=200℃ | T=300℃ | |
甲 | 0.8 | a | 96% | 94% | 90% |
乙 | 0.8 | b | 46% | 44% | 40% |
丙 | 0.8 | 4 | 95% | 88% | 80% |
下列说法正确的是
A.b<4
B.温度升高时,反应速率减慢,所以转化率下降
C.丙容器中,300℃平衡时,c(O2)=0.04molL-1
D.若甲容器温度在300时需要5min达到平衡,则此时间内v(Cl2)=0.036molL-1min-1