题目内容
【题目】下列说法正确的是( )
A.H2(g)+I2(g)![]() 2HI(g),平衡后,减压平衡不移动,气体颜色不变
2HI(g),平衡后,减压平衡不移动,气体颜色不变
B.H2(g)+I2(g)![]() 2HI(g),平衡后,加压平衡不移动,气体颜色不变
2HI(g),平衡后,加压平衡不移动,气体颜色不变
C.2NO2(g)![]() N2O4(g),平衡后,加压平衡正向移动,气体颜色变浅
N2O4(g),平衡后,加压平衡正向移动,气体颜色变浅
D.2NO2(g)![]() N2O4(g),平衡后,加压平衡正向移动,气体颜色先变深后变浅
N2O4(g),平衡后,加压平衡正向移动,气体颜色先变深后变浅
【答案】D
【解析】
A.反应H2(g)+I2(g)![]() 2HI(g)为气体体积不变的可逆反应,平衡后,减压平衡不移动,但体积增大,浓度减小,气体颜色变浅,选项A错误;
2HI(g)为气体体积不变的可逆反应,平衡后,减压平衡不移动,但体积增大,浓度减小,气体颜色变浅,选项A错误;
B. 反应H2(g)+I2(g)![]() 2HI(g)为气体体积不变的可逆反应,平衡后,加压平衡不移动,但体积减小,浓度增大,气体颜色变深,选项B错误;
2HI(g)为气体体积不变的可逆反应,平衡后,加压平衡不移动,但体积减小,浓度增大,气体颜色变深,选项B错误;
C. 反应2NO2(g)![]() N2O4(g)为气体体积缩小的可逆反应,平衡后,加压平衡正向移动,但容器体积缩小,反应物浓度均增大气体颜色先变深后变浅,选项C错误;
N2O4(g)为气体体积缩小的可逆反应,平衡后,加压平衡正向移动,但容器体积缩小,反应物浓度均增大气体颜色先变深后变浅,选项C错误;
D. 反应2NO2(g)![]() N2O4(g)为气体体积缩小的可逆反应,平衡后,加压平衡正向移动,但容器体积缩小,反应物浓度均增大气体颜色先变深后变浅,选项D正确。
N2O4(g)为气体体积缩小的可逆反应,平衡后,加压平衡正向移动,但容器体积缩小,反应物浓度均增大气体颜色先变深后变浅,选项D正确。
答案选D。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】某实验小组设计用50mL1.0 mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应。在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
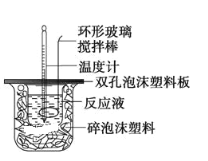
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热___(填“偏大”“偏小”或“不变”)。
(2)该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据。
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 24.8 | 25.2 | 25.0 | 31.6 | 6.6 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.2 | 25.0 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3 kJ/(g·℃),混合后溶液质量为m,反应放出的热量Q=cm△t,则该反应生成水的物质的量为____,中和热为ΔH=____。
(3)若用等浓度的盐酸与NH3·H2O溶液反应,则测得的中和热会___(填“偏大”“偏小”或“不变”),其原因是____。
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热____(填“偏大”“偏小”或“不变”)。